
【題目】用NA表示阿伏加德羅常數的值。下列敘述中不正確的是( )
A.標準狀況下,2.24LCH4中所含碳氫鍵的數目為0.4NA
B.1mol重水與1mol水中,中子數比為2:1
C.5.6g乙烯(C2H4)和環丁烷(C4H8)的混合氣體中含有的碳原子數為0.4NA
D.標準狀況下,11.2L二氧化碳與和足量的過氧化鈉反應,轉移的電子數為0.5NA
【答案】B
【解析】
A.一個甲烷分子由4個C-H鍵結合成正四面體;
B.重水分子為2H216O,水分子為1H216O;
C.乙烯(C2H4)和環丁烷(C4H8)最簡式均為CH2,乙烯(C2H4)和環丁烷(C4H8)的混合氣體可以看成是由一定物質的量的CH2組成的,且式量=12+2=14;
D.![]() ,過氧化鈉中4個-1價的O有2個升高到0價,2個降低到0價,故與方程式對應的轉移電子數為2e-。
,過氧化鈉中4個-1價的O有2個升高到0價,2個降低到0價,故與方程式對應的轉移電子數為2e-。
A.標準狀況下,n(CH4)=![]() =0.1mol,每個CH4分子中含4個C-H鍵,所以n(碳氫鍵)=0.1mol×4=0.4mol,所以標準狀況下,2.24LCH4中所含碳氫鍵的數目為0.4NA,A正確;
=0.1mol,每個CH4分子中含4個C-H鍵,所以n(碳氫鍵)=0.1mol×4=0.4mol,所以標準狀況下,2.24LCH4中所含碳氫鍵的數目為0.4NA,A正確;
B.重水分子為2H216O,水分子為1H216O,一個2H中中子數=2-1=1,一個H中中子數=1-1=0,一個16O中中子數=16-8=8,所以一個重水分子中中子數=1×2+8=10,一個水分子中中子數=0×2+8=8,所以1mol重水與1mol水中,中子數比為10:8=5:4,B錯誤;
C.乙烯(C2H4)和環丁烷(C4H8)最簡式均為CH2,乙烯(C2H4)和環丁烷(C4H8)的混合氣體可以看成是由一定物質的量的CH2組成的,且n(CH2)=![]() =0.4mol,所以n(C)=0.4mol×1=0.4mol,即5.6g乙烯(C2H4)和環丁烷(C4H8)的混合氣體中含有的碳原子數為0.4NA,C正確;
=0.4mol,所以n(C)=0.4mol×1=0.4mol,即5.6g乙烯(C2H4)和環丁烷(C4H8)的混合氣體中含有的碳原子數為0.4NA,C正確;
D.標況下,11.2L二氧化碳的物質的量=![]() =0.5mol,由
=0.5mol,由![]() 可知,每2mol二氧化碳反應對應轉移2mol電子, 所以0.5mol二氧化碳與和足量的過氧化鈉反應,轉移的電子的物質的量為0.5mol,即電子數為0.5NA,D正確。
可知,每2mol二氧化碳反應對應轉移2mol電子, 所以0.5mol二氧化碳與和足量的過氧化鈉反應,轉移的電子的物質的量為0.5mol,即電子數為0.5NA,D正確。
答案選B。


 課程達標測試卷闖關100分系列答案
課程達標測試卷闖關100分系列答案 新卷王期末沖刺100分系列答案
新卷王期末沖刺100分系列答案 全能闖關100分系列答案
全能闖關100分系列答案科目:高中化學 來源: 題型:
【題目】鹵素化學豐富多彩,能形成鹵化物、鹵素互化物、多鹵化物等多種類型的化合物。
(1)氣態氟化氫中存在二聚分子(HF)2,這是由于__。
(2)I3+屬于多鹵素陽離子,根據VSEPR模型推測I3+的空間構型為__,中心I原子的雜化軌道類型為__。
(3)基態溴原子的電子排布式為__,碘原子價電子的電子排布圖為__。
(4)鹵素互化物如IBr、ICl等與鹵素單質結構相似、性質相近。Cl2、IBr、ICl沸點由高到低的順序為__,I和Cl相比,電負性較大的是__,ICl中I元素的化合價為__。
(5)請推測①HClO4、②HIO4、③H5IO6[可寫成(HO)5IO]三種物質的酸性由強到弱的順序為__(填序號)。
(6)鹵化物RbICl2加熱時會分解為晶格能相對較大的鹵化物和鹵素互化物,該反應的化學方程式為__。RbICl2的晶體結構與CsCl相似,晶胞邊長為685.5pm,RbICl2晶胞中含有__個氯原子,RbICl2晶體的密度是__gcm-3(只要求列算式,不必計算出數值.阿伏伽德羅常數為NA)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學小組以環己醇![]() 制備環己烯.已知:
制備環己烯.已知:
密度(g/cm3) | 溶點(℃) | 沸點(℃) | 溶解性 | |
環已醇 | 0.96 | 25 | 161 | 能溶于水 |
環已烯 | 0.81 | ﹣103 | 83 | 難溶于水 |
(1)制備粗品將12.5mL環已醇加入試管A中,再加入1ml濃硫酸,搖勻后放入碎瓷片,緩慢加熱至反應完全,在試管C內得到環已烯粗品。
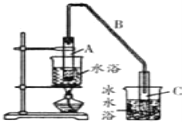
①A中碎瓷片的作用是_____________,導管B除了導氣外還具有的作用是_______。
②寫出環已醇制備環已烯的化學反應方程式___________________________。
③試管C置于冰水浴中的目的是____________________________。
(2)環已烯粗品中含有環已醇和少量酸性雜質等需要提純。
①加入飽和食鹽水,振蕩、靜置、分層,水在_______層(填上或下),分液后用_________(填入編號)洗滌。
a.KMnO4溶液 b.稀 H2SO4 c.Na2CO3溶液
②再將環已烯熱餾,蒸餾時要加入生石灰,目的是_____________________________。
③收集產品時,控制的溫度應在_________左右。
(3)以下區分環已烯精品和粗品的方法,合理的是_______。
a.用酸性高錳酸鉀溶液 b.用金屬鈉 c.溴水
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是實驗室制取SO2并驗證SO2的某些性質的裝置(夾持裝置和加熱裝置已略,氣密性已檢驗),請回答下列問題:
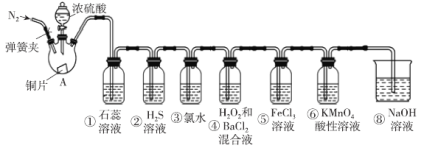
(1)在A中發生反應的化學方程式為___。
(2)①中的實驗現象為紫色石蕊溶液___。
②中的實驗現象為___,寫出此化學反應方程式___。
③中的實驗現象是___,寫出此化學反應方程式___。
④中的實驗現象是___,寫出此化學反應方程式___。
⑤中的現象是溶液由黃色變為淺綠色,其反應的離子方程式為___。
(3)能體現出SO2還原性的實驗序號是___。
(4)實驗結束后需要通入N2,其目的是___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗現象、結論及其推理都正確的是 ( )
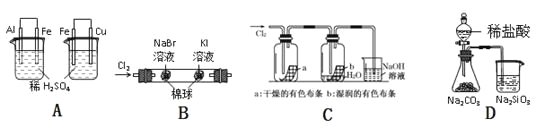
實驗 | 實驗現象 | 結論 |
A | 左燒杯中鐵不斷溶解,右燒杯中鐵表面有氣泡 | 活動性:Al>Fe>Cu |
B | 左邊棉花變為橙色,右邊棉花變為藍色 | 氧化性:Cl2>Br2>I2 |
C | a中布條不褪色,b中布條褪色 | 干燥氯氣無漂白性,潮濕的氯氣有漂泊性 |
D | 錐形瓶中有氣體產生,燒杯中液體變渾濁 | 非金屬性:Cl>C>Si |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于焓變![]() 的敘述或判斷正確的是
的敘述或判斷正確的是![]()
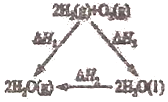
A.據如圖可知:![]()
B.由![]() 可知,若將含1mol
可知,若將含1mol![]() 的稀溶液與含1molNaOH的稀溶液混合,放出的熱量為
的稀溶液與含1molNaOH的稀溶液混合,放出的熱量為![]()
C.![]() 、30MPa下,將
、30MPa下,將![]() 和
和![]() 置于密閉容器中充分反應,放出
置于密閉容器中充分反應,放出![]() 熱量,則反應
熱量,則反應![]() 的
的![]()
D.![]() 在常溫下能自發進行,則該反應的
在常溫下能自發進行,則該反應的![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1) 在微生物作用的條件下,NH![]() 經過兩步反應被氧化成NO
經過兩步反應被氧化成NO![]() 。兩步反應的能量變化示意圖如下:
。兩步反應的能量變化示意圖如下:

① 第一步反應是________(填“放熱”或“吸熱”)反應,判斷依據是________________。
② 1 mol NH![]() (aq)全部氧化成NO
(aq)全部氧化成NO![]() (aq)的熱化學方程式是_______________________。
(aq)的熱化學方程式是_______________________。
(2) 已知紅磷比白磷穩定,則反應P4(白磷,s)+5O2(g)===2P2O5(s) ΔH1;4P(紅磷,s)+5O2(g)===2P2O5(s) ΔH2;ΔH1和ΔH2的關系是ΔH1________ΔH2 (填“>”“<”或“=”)。
(3) 在298 K、101 kPa時,已知:2H2O(g)===O2(g)+2H2(g) ΔH1
Cl2(g)+H2(g)===2HCl(g) ΔH2
2Cl2(g)+2H2O(g)===4HCl(g)+O2(g) ΔH3
則ΔH3與ΔH1和ΔH2之間的關系正確的是________。
A.ΔH3=ΔH1+2ΔH2 B.ΔH3=ΔH1+ΔH2
C.ΔH3=ΔH1-2ΔH2 D.ΔH3=ΔH1-ΔH2
(4) 已知:
2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1 ①
Na2O2(s)+CO2(g)===Na2CO3(s)+![]() O2(g) ΔH=-226 kJ·mol-1 ②
O2(g) ΔH=-226 kJ·mol-1 ②
則CO(g)與Na2O2(s)反應放出509 kJ熱量時,電子轉移數目為________________。
(5) 已知H2(g)+Br2(l)===2HBr(g) ΔH=-72 kJ·mol-1,蒸發1 mol Br2(l)需要吸收的能量為30 kJ,其他相關數據如下表:
物質 | H2(g) | Br2(g) | HBr(g) |
1 mol分子中的化學鍵斷 裂時需要吸收的能量(kJ) | 436 | 200 | a |
則表中a=________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】過渡金屬元素在日常生活中有廣泛的應用。
(1)金屬釩在材料科學上有重要作用,被稱為“合金的維生素”,基態釩原子的價層電子的排布式為__;基態Ni原子核外有__種運動狀態不同的電子,M層的電子云有__種不同的伸展方向。
(2)第四周期元素的第一電離能隨原子序數增大,總趨勢是逐漸增大的,但Se的第一電離能低于As,原因是___。
(3)NO2-與鈷鹽形成的配離子[Co(NO2)6]3-可用于檢驗K+的存在。大π鍵可用符號![]() 表示,其中m代表參與形成大π鍵的原子數,n為各原子的單電子數(形成σ鍵的電子除外)和得電子數的總和(如苯分子中的大π鍵可表示為
表示,其中m代表參與形成大π鍵的原子數,n為各原子的單電子數(形成σ鍵的電子除外)和得電子數的總和(如苯分子中的大π鍵可表示為![]() ,則NO2-中大π鍵應表示為__。
,則NO2-中大π鍵應表示為__。
(4)Mn3+在水溶液中容易歧化為MnO2和Mn2+,下列說法合理的是___。
A.Mn3+的價電子構型為3d4,不屬于較穩定的電子構型
B.根據Mn2+的電子構型可知,Mn2+中不含成對電子
C.第四周期元素中,錳原子價電子層中未成對電子數最多
D.Mn2+與Fe3+具有相同的價電子構型,所以它們的化學性質相似
(5)FeO是離子晶體,其晶格能可通過圖中的Born—Haber循環計算得到。
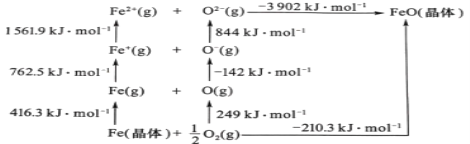
可知,O原子的第一電子親和能為___kJmol-1,FeO晶格能為___kJmol-1。
(6)銅與氧可形成如圖所示的晶胞結構,其中Cu均勻地分散在立方體內部,a、b的坐標參數依次為(0,0,0)、(![]() ,
,![]() ,
,![]() ),則d點的坐標參數為___,已知該晶體的密度為ρgcm-3,NA是阿伏加德羅常數的值,則晶胞參數為___pm。
),則d點的坐標參數為___,已知該晶體的密度為ρgcm-3,NA是阿伏加德羅常數的值,則晶胞參數為___pm。

(列出計算式即可)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在2 L的密閉容器中,發生以下反應:2A(g)+B(g) ![]() 2C(g)+D(g),若最初加入的A和B都是4 mol,在前10 s A的平均反應速率為0.12 mol/(L·s),則10 s時,容器中B的物質的量是( )
2C(g)+D(g),若最初加入的A和B都是4 mol,在前10 s A的平均反應速率為0.12 mol/(L·s),則10 s時,容器中B的物質的量是( )
A.3.4 molB.3.2 molC.2.8 molD.1.2 mol
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com