
【題目】將氣體A、B置于固定容積為2 L的密閉容器中,發生如下反應:3A(g)+B(g) ![]() 2C(g)+2D(g),反應進行到10 s末,達到平衡,測得A的物質的量為1.8 mol,B的物質的量為0.6 mol,C的物質的量為0.8 mol。
2C(g)+2D(g),反應進行到10 s末,達到平衡,測得A的物質的量為1.8 mol,B的物質的量為0.6 mol,C的物質的量為0.8 mol。
(1)用C表示10 s內反應的平均反應速率為______________。
(2)反應前A的物質的量濃度是______________。
(3)10 s末,生成物D的濃度為______________。
【答案】0.04mol·L-1·s-1 1.5mol·L-1 0.4mol·L-1
【解析】
(1)根據化學反應速率的數學表達式進行分析;
(2)A是反應物,反應前A的物質的量等于消耗A的物質的量+剩下A的物質的量,進行分析;
(3)根據化學反應方程式,利用C的物質的量計算出D的物質的量;
(1)根據化學反應速率的數學表達式,v(C)=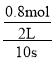 =0.04mol/(L·s);
=0.04mol/(L·s);
(2)達到平衡,生成C的物質的量為0.8mol,則消耗A的物質的量為![]() =1.2mol,則反應前A的物質的量為(1.2mol+1.8mol)=3mol,A的濃度為
=1.2mol,則反應前A的物質的量為(1.2mol+1.8mol)=3mol,A的濃度為![]() =1.5mol/L;
=1.5mol/L;
(3)根據反應方程式,生成C的物質的量等于生成D的物質的量,即n(D)=n(C)=0.8mol,即D的物質的量濃度為![]() =0.4mol·L-1。
=0.4mol·L-1。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】霧霾由多種污染物形成,其中包含顆粒物(包括PM 2.5在內)、氮氧化物(NOx)、CO、SO2等。化學在解決霧霾污染中有著重要的作用。
⑴ 已知:2SO2(g) + O2(g) ![]() 2SO3(g) △H =﹣196.6kJmol-1
2SO3(g) △H =﹣196.6kJmol-1
2NO(g) + O2(g) ![]() 2NO2(g) △H =﹣113.0kJmol-1
2NO2(g) △H =﹣113.0kJmol-1
則反應NO2(g) + SO2(g) ![]() SO3(g) + NO(g) △H =__________kJmol-1。
SO3(g) + NO(g) △H =__________kJmol-1。
一定條件下,將NO2與SO2以體積比1:2置于恒溫恒容的密閉容器中發生上述反應,下列能說明反應達到平衡狀態的有__________。
a、體系密度保持不變 b、混合氣體顏色保持不變
c、SO2和NO的體積比保持不變 d、每消耗1mol SO3的同時生成1mol NO2
測得上述反應平衡時NO2與SO2體積比為1:5,則平衡常數K=________________。
⑵ CO、CO2都可用于合成甲醇。甲醇既是重要的化工原料,又可作為燃料,近幾年開發的甲醇燃料電池采用鉑作電極催化劑,電池中的質子交換膜只允許質子和水分子通過。其工作原理的示意圖如圖1所示,回答下列問題。

① Pt(a)電極是電池的______極,電極反應式為:_________________。
② 如果該電池工作時電路中通過2 mol電子,則消耗的CH3OH有________mol。
③ CO用于合成甲醇反應方程式為:CO(g) + 2H2(g)![]() CH3OH (g) ,CO在不同溫度下的平衡轉化率與壓強的關系如圖2所示。實際的生產條件控制在250℃、1.3×104kPa左右,選擇此壓強的理由是____________。
CH3OH (g) ,CO在不同溫度下的平衡轉化率與壓強的關系如圖2所示。實際的生產條件控制在250℃、1.3×104kPa左右,選擇此壓強的理由是____________。
⑶ 圖3是一種用NH3脫除煙氣中NO的原理。
① 該脫硝原理中,NO最終轉化為H2O和__________(填化學式)。
② 當消耗2mol NH3和0.5mol O2時,除去的NO在標準狀況下的體積為__________L。
⑷ NO直接催化分解(生成N2和O2)也是一種脫硝途徑。在不同條件下,NO的分解產物不同。在高壓下,NO在40℃下分解生成兩種化合物,體系中各組分物質的量隨時間變化曲線如圖4所示,寫出NO分解的化學方程式______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】寫出下列物質的名稱:
A.(CH3)3CCH(CH3)(CH2)2CH(C2H5)2 A的名稱是________;
B.(CH3)3CC≡CCH2CH3 B的名稱是____;
C.![]() C的名稱是_____
C的名稱是_____
D.CH2OHCH(C2H5) CH2OH D的名稱是________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】二氯化二硫(S2Cl2)是一種重要的化工原料,常用作橡膠硫化劑,改變生橡膠受熱發粘、遇冷變硬的性質。查閱資料可知S2Cl2具有下列性質:
物理性質 | 毒性 | 色態 | 揮發性 | 熔點 | 沸點 |
劇毒 | 金黃色液體 | 易揮發 | -76℃ | 138℃ | |
化學性質 | ①300 ℃以上完全分解 ②S2Cl2+Cl2 ③遇高熱或與明火接觸,有引起燃燒的危險 ④受熱或遇水分解放熱,放出腐蝕性煙氣 | ||||
(1)制取少量S2Cl2
實驗室可利用硫與少量氯氣在110~140℃反應制得S2Cl2粗品,氯氣過量則會生成SCl2。
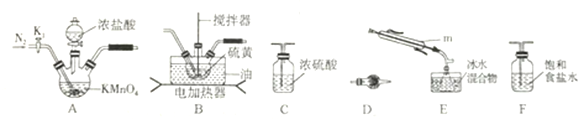
①儀器m 的名稱為__________,裝置F 中試劑的作用是_________。
②裝置連接順序: A![]() ______
______![]()
![]()
![]() E
E![]() D。
D。
③實驗前打開K1,通入一段時間的氮氣排盡裝置內空氣。實驗結束停止加熱后,再通入一段時間的氮氣,其目的是_____________。
④為了提高S2Cl2的純度,實驗的關鍵是控制好溫度和____________。
(2)少量S2Cl2泄漏時應噴水霧減慢其揮發(或擴散),并產生酸性懸濁液,但不要對泄漏物或泄漏點直接噴水,其原因是______________。
(3)S2Cl2遇水會生成SO2、HCl兩種氣體,某同學設計了如下實驗方案來測定該混合氣體中SO2的體積分數。
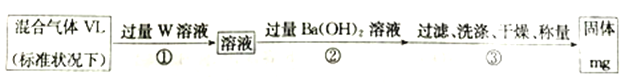
①W溶液可以是_____(填標號)。
a.H2O2溶液 b.KMnO4溶液(硫酸酸化) c.氯水
②該混合氣體中二氧化硫的體積分數為_________(用含V、m 的式子表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:有機物A的產量可以用來衡量一個國家的石油化工發展水平。現以A為主要原料合成乙酸乙酯,其合成路線如圖1所示。
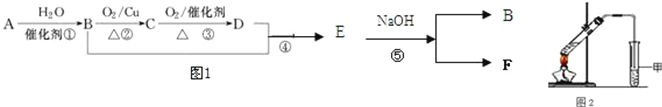
(1)B分子中官能團的名稱是________,D中官能團的名稱是_________;反應①的反應類型是__________反應。
(2)反應②的化學方程式是________________________________________,反應⑤的化學方程式是_________________________________________________。
(3)①某同學用如圖2所示的實驗裝置制取少量乙酸乙酯.實驗結束后,試管甲中上層為透明的、不溶于水的油狀液體。上述實驗中試管甲中試劑為___________________,其作用是(填字母)_____________。
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.乙酸乙酯在飽和碳酸鈉溶液中的溶解度比在水中更小,有利于分層析出
D.加速酯的生成,提高其產率
②在實驗室利用B和D制備乙酸乙酯的實驗中,若用1mol B和1mol D充分反應,_____(能/不能)生成1mol 乙酸乙酯,原因是_____________________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鋁、鐵、硅的單質及化合物在工業生產中具有廣泛應用,工業上常用某礦石(主要成分有Al2O3、Fe2O3、FeO、SiO2等)來制備綠礬(FeSO4·7H2O)和氧化鋁,其工藝流程如圖:
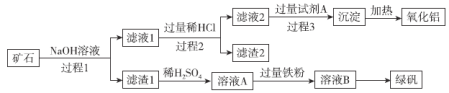
回答下列問題:
(1)濾渣1的成分是___,舉例說明濾渣2的用途___。
(2)用離子方程式表示溶液A加入過量鐵粉的目的是___。
(3)寫出由濾液1生成濾液2的離子方程式___。
(4)過程1、2、3均涉及分離操作,所需玻璃儀器有___。
(5)由溶液B得到綠礬的具體操作為___、過濾、洗滌和干燥。
(6)過程3需要加入的試劑A是___,寫出此過程的離子方程式___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C為原子序數依次遞增的前四周期的元素,A的第一電離能介于鎂和硫兩元素之間,A單質晶體的晶胞結構如圖2所示。B的價電子排布為(n+1)sn(n+1)pn+2,C位于元素周期表的ds區,其基態原子不存在不成對電子。B與C所形成化合物晶體的晶胞如圖3所示。
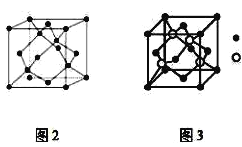
(1)A單質晶體屬于__晶體(填晶體類型)。其原子雜化方式為__。
(2)B與C所形成化合物晶體的化學式__。
(3)B與C所形成化合物晶體的密度為ag/cm3,則B原子之間最近距離為__cm。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NiSO4·6H2O是一種綠色易溶于水的晶體,廣泛用于化學鍍鎳、生產電池等。可由電鍍廢渣(除含鎳外,還含有Cu、Zn、Fe、Cr等雜質)為原料獲得。工藝流程如下圖:
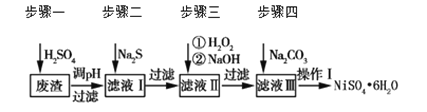
請回答下列問題:
(1)用稀硫酸溶解廢渣時,為了提高浸取率可采取的措施有_______(任寫一點)。
(2)向濾液中滴入適量的Na2S溶液,目的是除去Cu2+、Zn2+,寫出除去Cu2+的離子方程式________。
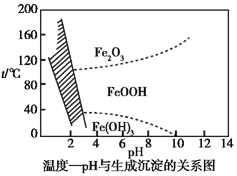
(3)在40 ℃左右,用6%的H2O2氧化Fe2+,再在95 ℃時加入NaOH調節pH,除去鐵和鉻。此外,還常用NaClO3作氧化劑,在較小的pH條件下水解,最終生成一種淺黃色的黃鐵礬鈉![]() (OH)12]沉淀除去。如圖是溫度—pH與生成的沉淀關系圖,圖中陰影部分是黃鐵礬穩定存在的區域[已知25 ℃時,Fe(OH)3的Ksp=2.64×10-39]。下列說法正確的是_______(選填序號)。
(OH)12]沉淀除去。如圖是溫度—pH與生成的沉淀關系圖,圖中陰影部分是黃鐵礬穩定存在的區域[已知25 ℃時,Fe(OH)3的Ksp=2.64×10-39]。下列說法正確的是_______(選填序號)。
a.FeOOH中鐵為+2價
b.若在25 ℃時,用H2O2氧化Fe2+,再在pH=4時除去鐵,此時溶液中c(Fe3+)=2.64×10-29
c.用氯酸鈉在酸性條件下氧化Fe2+的離子方程式為:6Fe2++Cl![]() +6H+
+6H+![]() 6Fe3++Cl-+3H2O
6Fe3++Cl-+3H2O
d.工業生產中常保持在85~95 ℃生成黃鐵礬鈉,此時水體的pH為1.2~1.8
(4)上述流程中濾液Ⅲ的主要成分是_______。
(5)確定步驟四中Na2CO3溶液足量,碳酸鎳已完全沉淀的簡單實驗方法是_______。
(6)操作Ⅰ的實驗步驟依次為(實驗中可選用的試劑:6 mol·L-1的H2SO4溶液、蒸餾水、pH試紙):
①___________;
②___________;
③蒸發濃縮、冷卻結晶,過濾得NiSO4·6H2O晶體;
④用少量乙醇洗滌NiSO4·6H2O晶體并晾干。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】三室式電滲析法處理含NH4NO3廢水的原理如圖所示,工作一段時間后,在兩極區均得到副產品NH4NO3。下列敘述錯誤的是( )
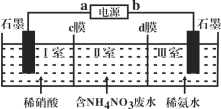
A.a極為電源負極,b極為電源正極
B.c膜是陽離子交換膜,d膜是陰離子交換膜
C.陽極電極反應式為4OH--4e-=O2↑+2H2O
D.Ⅱ室溶液的pH保持不變
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com