
【題目】甘氨酸亞鐵![]() 是一種補鐵強化劑廣泛用于缺鐵性貧血的預防和治療。某學習小組欲利用硫酸亞鐵溶液與甘氨酸反應制備甘氨酸亞鐵,有關物質性質如表:
是一種補鐵強化劑廣泛用于缺鐵性貧血的預防和治療。某學習小組欲利用硫酸亞鐵溶液與甘氨酸反應制備甘氨酸亞鐵,有關物質性質如表:
甘氨酸( | 檸檬酸 | 甘氨酸亞鐵 |
易溶于水,微溶于乙醇,兩性化合物 | 易溶于水和乙醇,有強酸性和還原性 | 易溶于水,難溶于乙醇 |
實驗過程
實驗1制備![]() :將含
:將含![]() 的溶液與
的溶液與![]() 溶液混合,反應結束后過濾并洗滌沉淀。
溶液混合,反應結束后過濾并洗滌沉淀。
實驗2制備![]() :
:
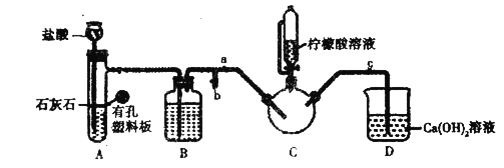
實驗裝置如圖(夾持和加熱儀器已省略),將實驗1得到的沉淀和含![]() 甘氨酸的水溶液混合后加入
甘氨酸的水溶液混合后加入![]() 中。利用
中。利用![]() 中的反應將
中的反應將![]() 中空氣排凈,接著滴入檸檬酸溶液并加熱。
中空氣排凈,接著滴入檸檬酸溶液并加熱。
實驗3提純![]() :反應結束后過,將濾液蒸發濃縮,加入乙醇,過濾、干燥得到產品。
:反應結束后過,將濾液蒸發濃縮,加入乙醇,過濾、干燥得到產品。
(1)寫出實驗1中制備![]() 的離子方程式_________________。
的離子方程式_________________。
(2)裝鹽酸的儀器名稱是__________,裝置![]() 中的試劑是__________。
中的試劑是__________。
(3)實驗2中,打開![]() 關閉
關閉![]() ,排盡空氣。確認
,排盡空氣。確認![]() 中空氣排盡的實驗現象是________________,排盡空氣后進行的實驗操作是________,接著滴入檸檬酸溶液并加熱。
中空氣排盡的實驗現象是________________,排盡空氣后進行的實驗操作是________,接著滴入檸檬酸溶液并加熱。
(4)實驗2中的檸酸可調節溶液![]() ,體系
,體系![]() 與產率的關系如表
與產率的關系如表
實驗 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
體系 | 4.0 | 4.5 | 5.0 | 5.5 | 6.0 | 6.5 | 7.0 |
產率(%) | 65.74 | 74.96 | 78.78 | 83.13 | 85.57 | 72.98 | 62.31 |
![]() 過低產率下降的原因是________________________;檸檬酸的作用還有_______。
過低產率下降的原因是________________________;檸檬酸的作用還有_______。
(5)實驗3中加入乙醇的目的是____________________。
(6)若產品的質量為![]() ,則產率為__________________%。
,則產率為__________________%。
【答案】![]() 長頸漏斗 飽和碳酸氫鈉溶液
長頸漏斗 飽和碳酸氫鈉溶液 ![]() 中澄清石灰水變渾濁 打開
中澄清石灰水變渾濁 打開![]() 關閉
關閉![]()
![]() 過低,氫離子會與甘氨酸中的氨基反應 防止亞鐵離子被氧化 減少甘氨酸亞鐵的溶解量,促使其結晶析出 80.00
過低,氫離子會與甘氨酸中的氨基反應 防止亞鐵離子被氧化 減少甘氨酸亞鐵的溶解量,促使其結晶析出 80.00
【解析】
FeSO4溶液與NH4HCO3溶液反應制備FeCO3沉淀,將FeCO3與和含0.20mol甘氨酸的水溶液混合后加入C中,然后利用A中的反應將C中空氣排盡,接著滴入檸檬酸溶液并加熱,反應結束后過濾,濾液經蒸發結晶、過濾、洗滌、干燥后得到產品,
(1)二價鐵離子與碳酸氫根離子反應生成碳酸鐵沉淀;
(2)根據儀器結構與特征解答;裝置B試劑的目的是除去二氧化碳中的氯化氫;
(3)根據實驗基本操作及現象分析;
(4)NH2CH2COOH中的氨基可以與氫離子結合,據此分析;檸檬酸有強酸性和還原性;
(5)根據甘氨酸亞鐵易溶于水,難溶于乙醇分析;
(6)根據題意,FeCO3過量,0.20mol甘氨酸反應完全,根據質量守恒有關系式:2NH2CH2COOH~(NH3CH3COO)2Fe,則理論上得到的(NH3CH3COO)2Fe的物質的量為![]() n(NH2CH2COOH)=0.10mol,質量為0.01mol×204g/mol=20.4g,據此計算。
n(NH2CH2COOH)=0.10mol,質量為0.01mol×204g/mol=20.4g,據此計算。
(1)Fe2+和HCO3-發生反應生成FeCO3沉淀、CO2和H2O,離子方程式為:Fe2++2HCO3-=FeCO3↓+CO2↑+ H2O,故答案為:Fe2++2HCO3-=FeCO3↓+CO2↑+ H2O;
(2)裝鹽酸的儀器為長頸漏斗,試劑B主要是為了除去二氧化碳中的氯化氫,則為飽和碳酸氫鈉溶液,故答案為:長頸漏斗;飽和碳酸氫鈉溶液;
(3)當C中充滿CO2后,CO2開始進入D中,使D中的澄清石灰水變渾濁,這時說明C中空氣已經排盡,故答案為:D中澄清石灰水變渾濁;利用A中的反應將C中空氣排盡后,打開![]() 關閉
關閉![]() 接著滴入檸檬酸溶液并加熱,故答案為:
接著滴入檸檬酸溶液并加熱,故答案為:![]() 中澄清石灰水變渾濁;打開
中澄清石灰水變渾濁;打開![]() 關閉
關閉![]() ;
;
(4)NH2CH2COOH中的氨基顯堿性,pH過低使產率下降的原因是H+會與NH2CH2COOH反應;根據信息,檸檬酸具有還原性和強酸性,能夠促進FeCO3的溶解,防止Fe2+被氧化;
故答案為:![]() 過低,氫離子會與甘氨酸中的氨基反應;防止亞鐵離子被氧化
過低,氫離子會與甘氨酸中的氨基反應;防止亞鐵離子被氧化
(5)由于甘氨酸亞鐵易溶于水,難溶于乙醇,故為降低甘氨酸亞鐵的溶解度,提高產率和純度,用乙醇洗滌,故答案為:減少甘氨酸亞鐵的溶解量,促使其結晶析出;
(6)根據題意,FeCO3過量,0.20 mol甘氨酸反應完全,根據質量守恒有關系式:2NH2CH2COOH(NH3CH3COO)2Fe,
則理論上得到的(NH3CH3COO)2Fe的物質的量為12n(NH2CH2COOH)=0.10
則產率為:![]() =80.00%,故答案為:80.00%。
=80.00%,故答案為:80.00%。


科目:高中化學 來源: 題型:
【題目】現有mg某氣體,它由雙原子分子構成,它的摩爾質量為Mg/mol。若阿伏加德羅常數用NA表示,則:
(1)該氣體的物質的量為________mol;
(2)該氣體所含原子總數為_________個;
(3)該氣體在標準狀況下的體積為_________L;
(4)該氣體溶于水后形成VL溶液,其溶液的物質的量濃度為_________mol/L。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鋯(![]() )是現代工業的重要金屬原料,具有良好的可塑性,抗蝕性能超過鈦。以鋯英石(主要成分是
)是現代工業的重要金屬原料,具有良好的可塑性,抗蝕性能超過鈦。以鋯英石(主要成分是![]() ,還含有少量
,還含有少量![]() 等雜質)為原料生產鋯及其化合物的流程如圖所示
等雜質)為原料生產鋯及其化合物的流程如圖所示

(1)寫出![]() 的電子式____________________。
的電子式____________________。
(2)高溫氣化過程中,不考慮損失,發現分餾后得到的![]() 質量通常比由純
質量通常比由純![]() 發生的反應得到的
發生的反應得到的![]() 質量大,用化學方程式來解釋原因_________________________。
質量大,用化學方程式來解釋原因_________________________。
(3)高溫氣化后的固體殘渣除碳外,還有![]() 和
和![]() ,加水浸取得氯化鐵溶液,過濾,從濾渣中分離出碳和
,加水浸取得氯化鐵溶液,過濾,從濾渣中分離出碳和![]() 兩種固體的方法是____________________。
兩種固體的方法是____________________。
(4)寫出上述流程中![]() 與水反應的化學方程式:____________________________。
與水反應的化學方程式:____________________________。
(5)已知氧化鋯(![]() )是一種兩性氧化物,與氫氧化鈉共熔融可形成酸鹽,請寫出化學方程式_________________________________________。
)是一種兩性氧化物,與氫氧化鈉共熔融可形成酸鹽,請寫出化學方程式_________________________________________。
(6)工業上可用鉀還原![]() 時制得金屬
時制得金屬![]() ,
,![]() 被還原時生成的鉀鹽的物質的量為_________________。
被還原時生成的鉀鹽的物質的量為_________________。
(7)已知![]() ,
,![]() 。下列說法正確的是__________
。下列說法正確的是__________
A.![]() ,電解質溶液的
,電解質溶液的![]() 與
與![]() 之和均為14
之和均為14
B.用鹽酸滴定某濃度的![]() 溶液,滴定過程中
溶液,滴定過程中![]() 逐漸增大
逐漸增大
C.![]() 溶液中逐滴加入硫酸溶液,滴加過程中
溶液中逐滴加入硫酸溶液,滴加過程中![]() 逐漸減小
逐漸減小
D.某溫度下![]() ,則其溶液中
,則其溶液中![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】ZrO2是重要的耐溫材料,可用作陶瓷遮光劑。天然鋯英石(ZrSiO4)含有鐵、鋁、銅等金屬元素的氧化物雜質,工業以鋯英石為原料制備ZrO2的工藝流程如下:

已知:Fe(SCN)3難溶于MIBK; Zr(SCN)4在水中溶解度不大,易溶于MIBK。
(1)鋯英石中鋯元素的化合價為____________。
(2)氯化主反應:ZrSiO4(s)+2C(s)+4Cl2(g) ![]() ZrCl4(g)+SiCl4(g)+2CO2(g) △H<0,ZrC14的產率隨溫度變化如圖所示,由圖可知氯化的最佳條件是_________。氯化過程ZrC14的產率隨溫度升高先增大后減小的原因是 __________。
ZrCl4(g)+SiCl4(g)+2CO2(g) △H<0,ZrC14的產率隨溫度變化如圖所示,由圖可知氯化的最佳條件是_________。氯化過程ZrC14的產率隨溫度升高先增大后減小的原因是 __________。

(3)寫出A12O3高溫氯化過程中轉化為AlC13的化學方程式___________________;
(4)Na2S、H2S、NaCN等均為常用的銅沉淀劑,本流程使用NaCN除銅,不采用Na2S、H2S的原因是__________(用離子方程式解釋)。若鹽酸溶解后溶液中c(Cu2+)=0.01mol/L,當溶液中Cu2+開始沉淀時,c(CN-)= ___________。(已知Ksp[Cu(CN)2]=4.00×10-10)
(5)實驗室進行萃取和反萃取的儀器是_______。流程中萃取與反萃取的目的是_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鉛蓄電池的示意圖如圖所示。下列說法正確的是

A. 放電時,N為負極,其電極反應式:PbO2+SO42-+4H++2e-=PbSO4+2H2O
B. 放電時,c(H2 SO4)不變,兩極的質量增加
C. 放電時,SO42-向M.N兩個電極移動
D. 放電時,正極反應式:PbSO4+2e-=Pb+SO42-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列離子方程式中,書寫錯誤的是( )
A.碳酸鈉溶液跟稀硫酸混合: CO32﹣+2H+=H2O+CO2↑
B.硝酸銅溶液中滴加燒堿溶液: Cu2++2OH-=Cu(OH)2↓
C.將CO2通入足量的氫氧化鈉溶液中: 2OH-+CO2=CO32﹣+H2O
D.硫酸溶液中加入Ba(OH)2溶液: Ba2++ SO![]() -=BaSO4↓
-=BaSO4↓
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】碳族元素(Carbon group)包括碳(C)、硅(Si)、鍺(Ge)、錫(Sn)、鉛(Pb)、鈇(Fl)六種。
(1)已知Sn為50號元素,其價電子排布式為 ______;價電子中成對電子數為______個。
(2)已知CO與N2的結構相似,則CO的電子式為______,C、O、N第一電離能由大到小的順序為______,三者最簡單氫化物的熔沸點高低順序為 ______(用“化學式”表示)。
(3)甲硅烷(SiH4)可用來制取超純半導體硅,工業上采用Mg2Si和NH4Cl在液氨介質中反應制得甲硅烷,該反應的化學方程式為___________。
(4)碳酸氫鈉的溶解度小于碳酸鈉,是由于HCO3-能夠形成雙聚或多聚鏈狀離子的結果,HCO3-中C原子的雜化方式為_______,HCO3-能夠雙聚或多聚的原因是__________。
(5) SiC作為C和Si唯一穩定的化合物,每個Si(或C)原子與周邊包圍的C(Si)原子通過________雜化相互結合。已經發現SiC具有250多種型體。某立方系晶體其晶胞參數為apm,阿伏加德羅常數的值為NA,該晶胞中原子的坐標參數為:
C部分原子:(0,0,0);(![]() ,
,![]() ,0);(
,0);(![]() ,0,
,0,![]() );(0,
);(0,![]() ,
,![]() )
)
Si全部原子:(![]() ,
,![]() ,
,![]() );(
);(![]() ,
,![]() ,
,![]() );(
);(![]() ,
,![]() ,
,![]() );(
);(![]() ,
,![]() )
)
該立方晶胞中Si原子構成的空間構型為_______,晶體的密度可表示為________g/cm3。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常用調味劑花椒油是一種從花椒籽中提取的水蒸氣揮發性香精油,溶于乙醇、乙醚等有機溶劑。利用如圖所示裝置處理花椒籽粉,經分離提純得到花椒油。

實驗步驟:
(一)在A裝置中的圓底燒瓶中裝入![]() 容積的水,加1~2粒沸石。同時,在B中的圓底燒瓶中加入20g花椒籽粉和50mL水。
容積的水,加1~2粒沸石。同時,在B中的圓底燒瓶中加入20g花椒籽粉和50mL水。
(二)加熱A裝置中的圓底燒瓶,當有大量蒸氣產生時關閉彈簧夾,進行蒸餾。
(三)向餾出液中加入食鹽至飽和,再用15mL乙醚萃取2次,將兩次萃取的醚層合并,加入少量無水Na2SO4;將液體傾倒入蒸餾燒瓶中,蒸餾得花椒油。
(1)裝置A中玻璃管的作用是_______。裝置B中圓底燒瓶傾斜的目的是 ________。
(2)步驟(二)中,當觀察到_______現象時,可停止蒸餾。蒸餾結束時,下列操作的順序為_______(填標號)。
①停止加熱②打開彈簧夾③關閉冷凝水
(3)在餾出液中加入食鹽的作用是__ ;加入無水Na2SO4的作用是_______。
(4)實驗結束后,用稀NaOH溶液清洗冷凝管,反應的化學方程式為_________。(殘留物以![]() 表示)
表示)
(5)為測定花椒油中油脂的含量,取20.00mL花椒油溶于乙醇中,加80.00mL0.5mol/LNaOH的乙醇溶液,攪拌,充分反應,加水配成200mL溶液。取25.00mL加入酚酞,用0.1moI/L鹽酸進行滴定,滴定終點消耗鹽酸20.00mL。則該花椒油中含有油脂_______ g/L。
(以 計,式量:884)。
計,式量:884)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于電解質溶液的敘述正確的是( )
A. 室溫下,pH=7的NH4Cl與氨水的混合溶液中離子濃度大小順序為:c(Cl-)>c(NH![]() )>c(H+)=c(OH-)
)>c(H+)=c(OH-)
B. 將pH=4的醋酸溶液稀釋后,溶液中所有離子的濃度均降低
C. 中和pH與體積均相同的鹽酸和醋酸溶液,消耗NaOH的物質的量相同
D. 室溫下,同濃度的Na2S與NaHS溶液相比,Na2S溶液的pH大
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com