
【題目】ZrO2是重要的耐溫材料,可用作陶瓷遮光劑。天然鋯英石(ZrSiO4)含有鐵、鋁、銅等金屬元素的氧化物雜質,工業以鋯英石為原料制備ZrO2的工藝流程如下:

已知:Fe(SCN)3難溶于MIBK; Zr(SCN)4在水中溶解度不大,易溶于MIBK。
(1)鋯英石中鋯元素的化合價為____________。
(2)氯化主反應:ZrSiO4(s)+2C(s)+4Cl2(g) ![]() ZrCl4(g)+SiCl4(g)+2CO2(g) △H<0,ZrC14的產率隨溫度變化如圖所示,由圖可知氯化的最佳條件是_________。氯化過程ZrC14的產率隨溫度升高先增大后減小的原因是 __________。
ZrCl4(g)+SiCl4(g)+2CO2(g) △H<0,ZrC14的產率隨溫度變化如圖所示,由圖可知氯化的最佳條件是_________。氯化過程ZrC14的產率隨溫度升高先增大后減小的原因是 __________。

(3)寫出A12O3高溫氯化過程中轉化為AlC13的化學方程式___________________;
(4)Na2S、H2S、NaCN等均為常用的銅沉淀劑,本流程使用NaCN除銅,不采用Na2S、H2S的原因是__________(用離子方程式解釋)。若鹽酸溶解后溶液中c(Cu2+)=0.01mol/L,當溶液中Cu2+開始沉淀時,c(CN-)= ___________。(已知Ksp[Cu(CN)2]=4.00×10-10)
(5)實驗室進行萃取和反萃取的儀器是_______。流程中萃取與反萃取的目的是_________。
【答案】+4 360℃、1MPa 360℃以前反應未達到平衡,升溫過程中反應繼續向正向進行,產率不斷增大;360℃以后反應達到平衡,由于該反應為放熱反應,升溫過程中平衡逆向移動,ZrCl4產率又減小 2Al2O3+3C+6Cl2![]() 4AlCl3+3CO2 2Fe3++H2S=2Fe2++S+2H+(2Fe3++S2-=2Fe2++S或2Fe3++3S2-=2FeS↓+S) 2×10-4mol/L 分液漏斗、燒杯 除去鐵元素雜質
4AlCl3+3CO2 2Fe3++H2S=2Fe2++S+2H+(2Fe3++S2-=2Fe2++S或2Fe3++3S2-=2FeS↓+S) 2×10-4mol/L 分液漏斗、燒杯 除去鐵元素雜質
【解析】
(1)根據化合物中元素正負化合價代數和等于0,結合Si、O元素化合價分析;
(2)制取ZrC14產率最大時為最合適的反應條件;根據溫度對化學反應速率和化學平衡移動的影響分析判斷;
(3) A12O3、焦炭在高溫下與氯氣反應產生AlCl3、CO2,根據電子守恒、原子守恒可得反應方程式;
(4)鋯英石(ZrSiO4)含有鐵元素的氧化物,在處理過程中有Fe3+,根據Fe3+與H2S或S2-發生的氧化還原反應分析判斷;根據Ksp[Cu(CN)2]=c(Cu2+)·c2(CN-)=4.00×10-10計算判斷;
(5)根據萃取是分離互不相溶的液體混合物的方法判斷儀器的使用;根據Fe(SCN)3難溶于MIBK;Zr(SCN)4在水中溶解度不大,易溶于MIBK分析萃取的目的。
(1)由于在化合物中元素正負化合價代數和等于0,O為-2價,Si為+4價,可得鋯英石(ZrSiO4)中Zr元素的化合價為+4價;
(2)根據圖像可知在ZrC14的產率在溫度為360℃、1MPa時最高,說明氯化的最佳條件是360℃、1MPa;
根據圖象可知:在360℃以前,隨著溫度的升高,ZrC14的產率逐漸增大,是由于溫度升高,反應物分子的能量增加,有效碰撞次數增加,反應速率加快,更多的反應物發生反應變為生成物,所以ZrC14的產率逐漸增大,到360℃達到最大值,此時反應達到平衡狀態,由于該反應的正反應為放熱反應,升高溫度,化學平衡向吸熱的逆反應方向移動,使ZrC14的產率逐漸降低,因此溫度升高,ZrC14的產率又逐漸降低;
(3) A12O3、焦炭在高溫下與氯氣反應產生AlCl3、CO2,根據電子守恒、原子守恒可得該反應方程式為:2Al2O3+3C+6Cl2![]() 4AlCl3+3CO2;
4AlCl3+3CO2;
(4)在鋯英石(ZrSiO4)含有鐵元素的氧化物,在粉碎、氯化處理過程中有Fe3+生成,Fe3+具有氧化性,而H2S或S2-具有還原性,會發生氧化還原反應:2Fe3++H2S=2Fe2++S+2H+或2Fe3++S2-=2Fe2++S或2Fe3++3S2-=2FeS↓+S,影響Cu2+的沉淀,若用NaCN,就不會發生上述反應;由于Ksp[Cu(CN)2]=c(Cu2+)·c2(CN-)=4.00×10-10,c(Cu2+)=0.01mol/L,當溶液中Cu2+開始沉淀時,c(CN-)=![]() =2.00×10-4mol/L;
=2.00×10-4mol/L;
(5)由于萃取是分離互不相溶的液體混合物的方法,所以萃取和反萃取使用的儀器有分液漏斗和燒杯;在處理過程中Cu2+與沉淀試劑形成Cu(CN)2沉淀過濾除去,Fe3+與加入的NH4SCN形成絡合物Fe(SCN)3,Zr4+形成Zr(SCN)4,由于Fe(SCN)3難溶于MIBK,而Zr(SCN)4在水中溶解度不大,易溶于MIBK,向Fe(SCN)3、Zr(SCN)4的混合溶液中加入MIBK充分振蕩后,分液,可將Fe(SCN)3分離除去,然后向MIBK的溶液中加入硫酸進行反萃取,Zr(SCN)4進入硫酸溶液中,然后經過一系列處理,就可得到ZrO2。所以進行萃取和反萃取目的是除去鐵元素雜質。


科目:高中化學 來源: 題型:
【題目】O2和O3是氧元素的兩種單質,根據其分子式完成下列各題:
(1)等質量的O2和O3所含分子個數比為___,原子個數比為___。
(2)同溫同壓下,等體積的O2和O3質量比為___。
(3)配制100mL1mol·L-1的稀H2SO4溶液,需要用量筒量取濃H2SO4(密度為1.84g·mL-1,質量分數為98%)的體積為___mL。
(4)現要配制1mol·L-1Na2CO3溶液250mL,需要含結晶水的碳酸鈉晶體(Na2CO3·10H2O)___g。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)AlCl3溶液呈________性(填“酸”“中”或“堿”),原因是____________________________(用離子方程式表示)。把AlCl3溶液蒸干、灼燒,最后得到的主要固體產物是____________________(寫化學式)。實驗室在保存AlCl3溶液時,常在溶液中加少量的________,以抑制其水解。
(2)將等體積等物質的量濃度的醋酸和氫氧化鈉溶液混合后,溶液呈________性(填“酸”“中”或“堿”),溶液中[Na+]________[CH3COO-](填“>”“=”或“<”)。
(3)25 ℃時,pH=3的醋酸和pH=11的氫氧化鈉溶液等體積混合后溶液呈________性(填“酸”“中”或“堿”),溶液中,[Na+]________[CH3COO-](填“>”“=”或“<”)。
(4)物質的量濃度相同的醋酸和氫氧化鈉溶液混合后,溶液中醋酸根離子和鈉離子濃度相等,則混合后溶液呈________性(填“酸”“中”或“堿”),醋酸體積________氫氧化鈉溶液體積(填“>”“=”或“<”)。
(5)已知0.1 mol·L-1的NaHCO3溶液pH=9,則溶液中[CO32-]________[H2CO3](填“>”“=”或“<”),其溶液顯電中性的原因是________________________(用離子濃度關系式表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,濃度均為0.1 mol·Lˉ1的NaOH溶液和氨水,下列說法正確的是
A. c(NH3H2O) + c(NH4+) = c(Na+)
B. NH3的水溶液能導電,所以NH3是電解質
C. 氨水的pH大于NaOH溶液
D. 將濃度為0.1 mol·Lˉ1的鹽酸和氨水等體積混合后,所得溶液中:c(OH-) > c(H+)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據如圖所示示意圖,下列說法不正確的是

A. 反應的熱化學方程式可表示為C(s)+H2O(g)![]() CO(g)+H2(g) ΔH=(b-a) kJ·mol-1
CO(g)+H2(g) ΔH=(b-a) kJ·mol-1
B. 該反應過程反應物斷鍵吸收的能量大于生成物成鍵放出的能量
C. a mol C和a mol H2O反應生成a mol CO和a mol H2吸收的熱量一定為131.3a kJ
D. 1 mol C(g)、2 mol H、1 mol O轉變成1 mol CO(g)和1 mol H2(g)放出的熱量為a kJ
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為了科學飲食,了解一些與食品相關的化學知識是必要的。
(1)油炸蝦條、薯片等容易擠碎的食品,不宜選用真空袋裝,而應采用充氣袋裝。下列氣體中不應該充入的是________(填序號,下同)。
A.氮氣 B.二氧化碳
C.空氣 D.氧氣
(2)為使以面粉為原料的面包松軟可口,通常用碳酸氫鈉作發泡劑,因為它________。
A.熱穩定性差 B.增加甜味
C.產生二氧化碳 D.提供鈉離子
(3)能直接鑒別氯化鈉和葡萄糖兩種未知濃度溶液的方法是________。
A.觀察顏色 B.測量比值
C.加熱灼燒 D.分別聞味
(4)苯甲酸鈉是常用的食品防腐劑,其結構簡式如圖。以下對苯甲酸鈉描述錯誤的是________。

A.屬于鹽類 B.能溶于水
C.屬于烴類 D.不易分解
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甘氨酸亞鐵![]() 是一種補鐵強化劑廣泛用于缺鐵性貧血的預防和治療。某學習小組欲利用硫酸亞鐵溶液與甘氨酸反應制備甘氨酸亞鐵,有關物質性質如表:
是一種補鐵強化劑廣泛用于缺鐵性貧血的預防和治療。某學習小組欲利用硫酸亞鐵溶液與甘氨酸反應制備甘氨酸亞鐵,有關物質性質如表:
甘氨酸( | 檸檬酸 | 甘氨酸亞鐵 |
易溶于水,微溶于乙醇,兩性化合物 | 易溶于水和乙醇,有強酸性和還原性 | 易溶于水,難溶于乙醇 |
實驗過程
實驗1制備![]() :將含
:將含![]() 的溶液與
的溶液與![]() 溶液混合,反應結束后過濾并洗滌沉淀。
溶液混合,反應結束后過濾并洗滌沉淀。
實驗2制備![]() :
:
實驗裝置如圖(夾持和加熱儀器已省略),將實驗1得到的沉淀和含![]() 甘氨酸的水溶液混合后加入
甘氨酸的水溶液混合后加入![]() 中。利用
中。利用![]() 中的反應將
中的反應將![]() 中空氣排凈,接著滴入檸檬酸溶液并加熱。
中空氣排凈,接著滴入檸檬酸溶液并加熱。
實驗3提純![]() :反應結束后過,將濾液蒸發濃縮,加入乙醇,過濾、干燥得到產品。
:反應結束后過,將濾液蒸發濃縮,加入乙醇,過濾、干燥得到產品。
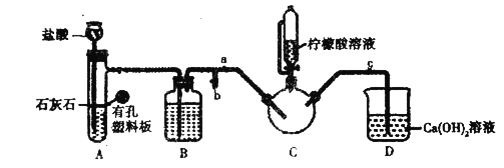
(1)寫出實驗1中制備![]() 的離子方程式_________________。
的離子方程式_________________。
(2)裝鹽酸的儀器名稱是__________,裝置![]() 中的試劑是__________。
中的試劑是__________。
(3)實驗2中,打開![]() 關閉
關閉![]() ,排盡空氣。確認
,排盡空氣。確認![]() 中空氣排盡的實驗現象是________________,排盡空氣后進行的實驗操作是________,接著滴入檸檬酸溶液并加熱。
中空氣排盡的實驗現象是________________,排盡空氣后進行的實驗操作是________,接著滴入檸檬酸溶液并加熱。
(4)實驗2中的檸酸可調節溶液![]() ,體系
,體系![]() 與產率的關系如表
與產率的關系如表
實驗 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
體系 | 4.0 | 4.5 | 5.0 | 5.5 | 6.0 | 6.5 | 7.0 |
產率(%) | 65.74 | 74.96 | 78.78 | 83.13 | 85.57 | 72.98 | 62.31 |
![]() 過低產率下降的原因是________________________;檸檬酸的作用還有_______。
過低產率下降的原因是________________________;檸檬酸的作用還有_______。
(5)實驗3中加入乙醇的目的是____________________。
(6)若產品的質量為![]() ,則產率為__________________%。
,則產率為__________________%。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列熱化學方程式正確的是( )
A. 表示硫的燃燒熱的熱化學方程式S(s)+![]() O2(g)=SO3(g);ΔH=-315 kJ·mol-1
O2(g)=SO3(g);ΔH=-315 kJ·mol-1
B. 表示中和熱的熱化學方程式NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);ΔH=-57.3 kJ·mol-1
C. 表示H2燃燒熱的熱化學方程式H2(g)+![]() O2(g)=H2O(g);ΔH=-241.8 kJ·mol-1
O2(g)=H2O(g);ΔH=-241.8 kJ·mol-1
D. 表示CO燃燒熱的熱化學方程式2CO(g)+O2(g)=2CO2(g);ΔH=-566 kJ·mol-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】高分子化合物M的合成路線如下:

已知:![]()
(1)A中含氧官能團的名稱是______。
(2)反應①的試劑和條件為_______,B的結構簡式為______。
(3)D為酯類,以乙醛為原料,寫出合成D所涉及的化學方程式______。
(4)2 D → E + C2H5OH,F中含有醇羥基,寫出下列物質的結構簡式:E________ F________G___
(5)反應①~⑥中屬于取代反應的有______。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com