
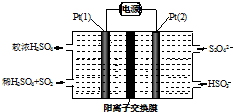
 工業尾氣SO2有多種吸收和處理方法.
工業尾氣SO2有多種吸收和處理方法.分析 (1)Na2SO3溶液吸收SO2生成NaHSO3;
(2)①Pt(1)電極進入SO2,硫酸濃度增大,SO2可知失電子,作負極,電極上二氧化硫被氧化生成硫酸;
②左側電極反應式為:SO2-2e-+2H2O=SO42-+4 H+,根據電子轉移守恒計算生成硫酸根、氫離子的物質的量,為保持溶液電中性,多余的氫離子通過陽離子交換膜移至右側,左側溶液中增加離子為生成硫酸電離的離子總量.
解答 解:(1)Na2SO3溶液吸收SO2的離子方程式為SO32-+SO2+H2O=2HSO3-,故答案為:SO32-+SO2+H2O=2HSO3-;
(2)①由圖可知,Pt(1)電極上二氧化硫被氧化生成硫酸,電極反應式為:SO2-2e-+2H2O=SO42-+4 H+,
故答案為:SO2-2e-+2H2O=SO42-+4H+;
②左側電極反應式為:SO2-2e-+2H2O=SO42-+4H+,根據電子轉移守恒,生成硫酸根物質的量$\frac{0.02mol}{2}$=0.01mol,生成氫離子為0.04mol,為保持溶液電中性,0.01mol硫酸根需要0.02mol氫離子,多余的氫離子通過陽離子交換膜移至右側,即有0.02mol氫離子移至右側,故左側溶液中增加離子為0.01mol+0.02mol=0.03mol,
故答案為:0.03.
點評 本題涉及電極反應式書寫、電解池有關計算等,需要學生具備扎實的基礎,側重考查學生對知識的遷移應用,(2)中左側溶液中增加離子物質的量計算為易錯點,學生容易根據電極反應式計算,忽略部分氫離子移至右側.


科目:高中化學 來源: 題型:選擇題
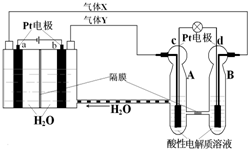 RFC是一種將水電解技術與氫氧燃料電池技術相互結合的可充電電池,RFC工作原理如圖所示.則下列有關說法正確的是( )
RFC是一種將水電解技術與氫氧燃料電池技術相互結合的可充電電池,RFC工作原理如圖所示.則下列有關說法正確的是( )| A. | c電極發生還原反應,B池中H+通過隔膜進入A池 | |
| B. | b電極上發生的電極反應是:2H2O+2e-═H2↑+2OH- | |
| C. | 轉移0.1mol電子時,a電極產生標準狀況O21.12L | |
| D. | d電極上發生的電極反應是:O2+4H++4e-═2H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
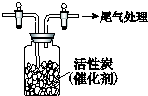 某學習小組依據SO2具有還原性,推測SO2能被Cl2氧化生成SO2Cl2.
某學習小組依據SO2具有還原性,推測SO2能被Cl2氧化生成SO2Cl2.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 若溶液pH=7,則c(A-)=c(HA) | |
| B. | 若c(A-)>c(HA),則溶液中水電離的c(H+)<1.0×10-7mol/L | |
| C. | 若pH>7,加水稀釋c(A-)/c(HA)增大 | |
| D. | 溶液中,c(A-)=2c(H+)+c(HA)-2c(OH-) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 最高價氧化物對應水化物的堿性大小順序一定是:X>Y | |
| B. | 離子半徑和原子半徑由大到小的順序均為X>Y>Z>W | |
| C. | 氫化物的穩定性是Z>W;氫化物的沸點是Z<W | |
| D. | 還原性Zm->W(m+1)-,氧化性Xn+>Y(n+1)+ |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
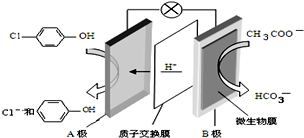 污水治理越來越引起人們重視,可以通過膜電池除去廢水
污水治理越來越引起人們重視,可以通過膜電池除去廢水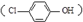 中的乙酸鈉和對氯苯酚,其原理如圖所示,下列說法不正確的( )
中的乙酸鈉和對氯苯酚,其原理如圖所示,下列說法不正確的( )| A. | A為電池的正極,發生還原反應 | |
| B. | 電流方向從B極沿導線經小燈泡流向A極 | |
| C. | A極的電極反應式為 | |
| D. | 當外電路中有0.2mole-轉移時,進入A極區的H+的個數為0.2NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1molCl2與足量的鐵粉反應,反應轉移電子的數目為3NA | |
| B. | 室溫時,足量Zn與濃硫酸反應共產生2mol氣體,轉移電子數為4NA | |
| C. | 7.8gNa2O2與足量水反應時轉移電子數目為0.2NA | |
| D. | 1mol二氧化氮氣體久置后在標準狀況下的體積為22.4L |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com