
 SO2在物質的研究和制備過程中有重要的用途,既可以作為原料又可作為溶劑,請回答下列問題:
SO2在物質的研究和制備過程中有重要的用途,既可以作為原料又可作為溶劑,請回答下列問題:分析 (1)①銅的原子序數為29,Cu2+核外有27個電子,每個電子的運動狀態各不相同;根據二氧化硫中S原子的價層電子對數判斷;
②CuCl2與SO2反應生成CuCl沉淀和硫酸;
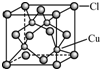
③根據晶體結構特點分析Cl原子的配位數;.
(2)根據中心原子的價層電子對數判斷,價層電子對數=成鍵電子對數+孤電子對數;根據化合物中元素化合價規律和8電子穩定結構分析;Ga為第四周期、第IIIA族元素,原子核外有31個電子,分四層排布,最外層有3個電子.
解答 解:(1)①根據銅的原子序數為29,其核外有29個電子,失去2個電子形成Cu2+,則Cu2+核外有27個電子,每個電子的運動狀態各不相同,所以有27種運動狀態不同的電子;二氧化硫中S原子的價層電子對數=2+$\frac{1}{2}$(6-2×2)=3,而且含有1個孤電子對,所以SO2的空間構型為V形;
故答案為:27;V形;
②CuCl2與SO2反應生成CuCl沉淀和硫酸,其反應的離子方程式為:2Cu2++2Cl-+SO2+2H2O$\frac{\underline{\;加熱\;}}{\;}$2CuCl↓+4H++SO42-;
故答案為:2Cu2++2Cl-+SO2+2H2O$\frac{\underline{\;加熱\;}}{\;}$2CuCl↓+4H++SO42-;
③從CuCl的晶胞可以判斷,每個銅原子與4個Cl距離最近且相等,即Cu的配位數為4,故答案為:4.
(2)[SbCl2+]中Sb的價層電子對數=2+$\frac{1}{2}$(5-1+2×1)=3,則Sb的雜化類型為sp2,[GaCl2+]中Ga的價層電子對數=2+$\frac{1}{2}$(3-1+2×1)=2,則Ga的雜化類型為sp;
[SbCl2+][GaCl4-]中陽離子Sb呈+3價屬合N族元素價鍵規律,陰離子Ga有三個電子與三個Cl原子形成三個共用電子對后還有一個空P軌道,可以結合一個氯離子形成8電子穩定結構;[GaCl2+][SbCl4-]中陽離子鎵呈正三價屬合第IIIA族元素價鍵規律,但是陰離子中Sb原子周圍卻有9個電子,比8電子穩定結構多一個電子,故不穩定,因此結構應是[SbCl2+][GaCl4-];
Ga為第四周期、第IIIA族元素,原子核外有31個電子,分四層排布,最外層有3個電子,其電子排布式為:[Ar]3d104s24p1;
故答案為:sp2;sp;[SbCl2+][GaCl4-];[Ar]3d104s24p1.
點評 本題綜合考查物質的結構與性質知識,側重于雜化類型的判斷、電子排布式、分子的立體構型、離子方程的書寫等知識,題目難度中等,注意把握雜化類型的判斷方法.


科目:高中化學 來源: 題型:解答題
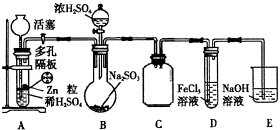
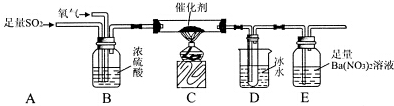
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①>②>③>④ | B. | ③>④>①>② | C. | ③>①>④>② | D. | ④>③>②>① |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
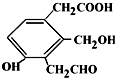 則Na、NaOH、NaHCO3分別與等物質的量的該物質反應時,消耗Na、NaOH、NaHCO3的物質的量之比為( )
則Na、NaOH、NaHCO3分別與等物質的量的該物質反應時,消耗Na、NaOH、NaHCO3的物質的量之比為( )| A. | 3:3:3 | B. | 3:2:2 | C. | 3:2:1 | D. | 1:1:1 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
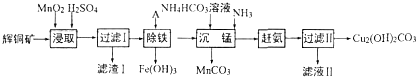
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
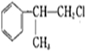
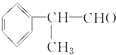 )是一種重要的化工原料,其合成路線如下
)是一種重要的化工原料,其合成路線如下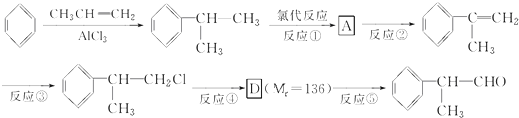
 +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$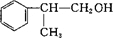 +NaCl.
+NaCl.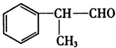 +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$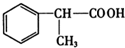 +Cu2O↓+2H2O.
+Cu2O↓+2H2O.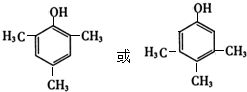 .
.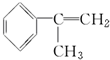 為原料制備
為原料制備 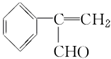 的化學方程式(無機試劑任用).
的化學方程式(無機試劑任用). +Br2→
+Br2→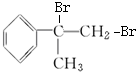 、
、 +2NaOH$→_{△}^{水}$
+2NaOH$→_{△}^{水}$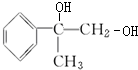 +2NaBr、
+2NaBr、 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2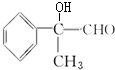 +2H2O、
+2H2O、 $→_{△}^{濃硫酸}$
$→_{△}^{濃硫酸}$ +H2O.
+H2O.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CH3CH2CH(CH3)CH(CH3)OH 3-甲基-4-戊醇 | |
| B. |  3-甲基丁烯 3-甲基丁烯 | |
| C. |  2-甲基丁烷 2-甲基丁烷 | |
| D. | CH2Cl-CH2Cl 二氯乙烷 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | “四中子”不顯電性 | |
| B. | “四中子”的質量數為4,其質量比氫原子大 | |
| C. | “零號元素”在元素周期表中與氫元素占同一位置 | |
| D. | 第二種粒子的化學式為O4,與O2互為同素異形體 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com