
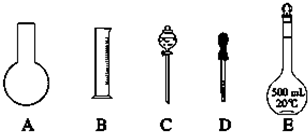
| n |
| V |
| 1000×1.84g/ml×98% |
| 98g/mol |


科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
 實驗室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液500mL.根據這兩種溶液的配制情況回答下列問題:
實驗室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液500mL.根據這兩種溶液的配制情況回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
 歐盟原定于2012年1月1日起征收航空碳排稅以應對冰川融化和全球變暖,使得對如何降低大氣中CO2的含量及有效地開發利用碳資源的研究顯得更加緊迫.請運用化學反應原理的相關知識研究碳及其化合物的性質.
歐盟原定于2012年1月1日起征收航空碳排稅以應對冰川融化和全球變暖,使得對如何降低大氣中CO2的含量及有效地開發利用碳資源的研究顯得更加緊迫.請運用化學反應原理的相關知識研究碳及其化合物的性質.| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、室溫下,測0.1 mol/L HX溶液的pH>1,證明HX是弱酸 |
| B、室溫下,將等濃度等體積的鹽酸和NaX溶液混合,若混合溶液pH<7,證明HX是弱酸 |
| C、室溫下,測1 mol/L NaX的pH,若pH>7,證明HX是弱酸 |
| D、在相同條件下,對0.1 mol/L的鹽酸和0.1 mol/L的HX溶液進行導電性實驗,若HX溶液燈泡較暗,證明HX為弱酸 |
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、濃度相等的HCl與HA,跟鋅反應生成氫氣的速率HCl比HA快 |
| B、pH相等的HCl與HA兩溶液體積相同時,跟鎂反應生成氫氣HA比HCl多 |
| C、濃度相等的NaCl與NaA兩溶液,前者是中性而后者為堿性 |
| D、濃度相等體積相同的HCl與HA兩溶液與足量氫氧化鈉溶液反應時,消耗的氫氧化鈉一樣多 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com