

分析 (1)化學反應熱△H=反應物總鍵能-生成物總鍵能計算反應熱;
(2)①由能量變化圖計算反應熱,反應熱=反應物的鍵能和-生成物的鍵能和,從而書寫熱化學方程式;
②反應自發進行的判斷依據是△H-T△S<0.
解答 解:(1)反應熱△H=反應物總鍵能-生成物總鍵能,所以對于S(s)+3F2(g)═SF6(g),其反應熱△H=280kJ/mol+3×160kJ/mol-6×330kJ/mol=-1220kJ/mol,
故答案為:-1220kJ/mol;
(2)①該反應中的反應熱=反應物的鍵能和-生成物的鍵能和=(945+498)kJ/mol-2×630kJ/mol=+183kJ/mol,所以N2和O2反應生成NO的熱化學反應方程式為N2(g)+O2(g)=2NO(g)△H=+183kJ•mol-1;
故答案為:N2(g)+O2(g)=2NO(g)△H=+183KJ/mol;
②已知該反應的△S﹦247.7J•mol-1•K-1,△H=+183KJ/mol,反應自發進行需要滿足△H-T△S<0,代入計算得到:+183KJ/mol-T×247.7×10-3KJ•mol-1•K-1<0,
T>739K,溫度t=739-273=466°C,室溫下不能自發進行,
故答案為:不能.
點評 本題考查了反應熱量變化的計算、反應自發進行的判斷依據,反應熱=反應物的鍵能和-生成物的鍵能和,掌握基礎是解題關鍵,題目難度不大.


科目:高中化學 來源: 題型:選擇題
| A. | Na+、Ba2+、AlO2-、NO3- | B. | K+、Na+、HSO3-、Cl- | ||
| C. | NH4+、K+、Cl-、NO3- | D. | Fe3+、Na+、ClO-、S2- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
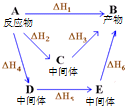
| A. | 組成為C4H8的化合物性質都相同 | |
| B. | 氫彈原料D、T,可由${\;}_1^1$H在化學反應中制取 | |
| C. | 粗銅電解精煉時,陽極減少的質量一定等于陰極增加的質量 | |
| D. | 圖中物質A經不同途徑生成B時,焓變滿足:△H1=△H2+△H3=△H4+△H5+△H6 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 短周期元素Q、R、T、W在元素周期表中位置如圖所示,其中T所處的周期序數與主族序數相等,
短周期元素Q、R、T、W在元素周期表中位置如圖所示,其中T所處的周期序數與主族序數相等, ,R的最簡單氫化物的電子式為
,R的最簡單氫化物的電子式為 ,Q的1:1型氫化物中相對分子質量最小的分子是直線型分子(立體構型).
,Q的1:1型氫化物中相對分子質量最小的分子是直線型分子(立體構型).查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
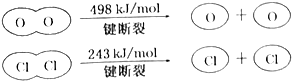
| A. | 反應A的△H>-115.6kJ•mol-1 | |
| B. | H2O中H-O鍵比HCl中H-Cl鍵弱 | |
| C. | 由II中的數據判斷氯元素的非金屬性比氧元素強 | |
| D. | 斷開1molH-O鍵與斷開1molH-Cl鍵所需能量相差31.9kJ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①④ | B. | ①② | C. | ②③ | D. | ②④ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com