

分析 (1)由①CO(g)+2H2(g)?CH3OH(g)△H1=-100kJ•mol-1
②CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H2=-58kJ•mol-1
結合蓋斯定律可知,②-①得到CO2(g)+H2(g)?CO(g)+H2O(g);
(2)③=②-①,則K為指數關系,升高溫度平衡向吸熱的方向移動;
(3)由圖可知$\frac{n({H}_{2})}{n(CO+C{O}_{2})}$=2.60時、相同溫度下,增大壓強,有利于平衡向正反應方向移動,CO的轉化率增大;
(4)甲醇在催化劑作用下提供質子(H+)和電子,則負極上甲醇失去電子生成二氧化碳.
解答 解:(1)由①CO(g)+2H2(g)?CH3OH(g)△H1=-100kJ•mol-1
②CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H2=-58kJ•mol-1
結合蓋斯定律可知,②-①得到CO2(g)+H2(g)?CO(g)+H2O(g),則△H3=(-58kJ•mol-1)-(-100kJ•mol-1)=+42kJ•mol-1,
故答案為:+42;
(2)③=②-①,可知①=②-③,則K1=$\frac{{K}_{2}}{{K}_{3}}$,③為吸熱反應,隨著溫度的升高,平衡正向移動,K3增大,
故答案為:$\frac{{K}_{2}}{{K}_{3}}$;增大;
(3)相同溫度下,反應③前后氣體分子數不變,壓強改變不影響其平衡移動,反應①②的正反應均為氣體分子數減小的反應,增大壓強,有利于平衡向正反應方向移動,CO的轉化率增大,故增大壓強有利于CO的轉化率升高,結合圖可知,最上方壓強對應轉化率最大,則壓強為p1<p2<p3,
故答案為:p1<p2<p3;
(4)甲醇在催化劑作用下提供質子(H+)和電子,則負極上甲醇失去電子生成二氧化碳,負極反應為CH3OH+H2O-6e-=CO2+6H+,
故答案為:CH3OH+H2O-6e-=CO2+6H+.
點評 本題考查反應熱與焓變、平衡常數、平衡移動及原電池,為高頻考點,把握蓋斯定律應用、反應的關系、平衡移動原理及電極反應書寫為解答的關鍵,側重分析與應用能力的考查,綜合性較強,題目難度不大.


 快樂5加2金卷系列答案
快樂5加2金卷系列答案科目:高中化學 來源: 題型:選擇題
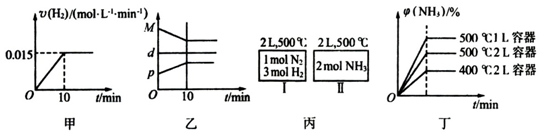
| A. | 若達到平衡時,測得體系放出9.24kJ熱量,則H2反應速率變化曲線如圖甲所示 | |
| B. | 反應過程中,混合氣體平均相對分子質量為M,混合氣體密度為d,混合氣體壓強為p,三者關系如圖乙 | |
| C. | 如圖丙所示,容器I和II達到平衡時,NH3的體積分數為φ,則容器I放出熱量與容器II吸收熱量之和為92.4kJ | |
| D. | 若起始加入物料為1 mol N2,3 mol H2,在不同條件下達到平衡時,NH3的體積分數變化如圖丁所示 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 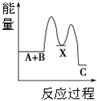 反應A+B→C(△H<0)分兩步進行:①A+B→X(△H>0),②X→C(△H<0),圖表示總反應過程中能量變化 | |
| B. | 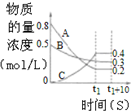 圖表示反應的化學方程式為3A+B═2C | |
| C. | 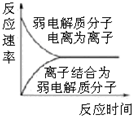 圖表示弱電解質在水中建立電離平衡的過程 | |
| D. | 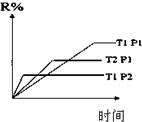 圖表示反應M(g)+N(g)?R(g)+2L(?)是放熱反應且L是氣體 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 加水時,平衡向逆反應方向移動 | |
| B. | 通入少量HCl,平衡向正反應方向移動 | |
| C. | 加入少量0.1mol/LNaOH,溶液中c(OH-)減小 | |
| D. | 加入少量NH4Cl固體,平衡向逆反應方向移動 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
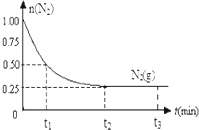 一定溫度下,在體積為2L的恒容密閉容器中充入1mol N2和3mol H2,一定條件下發生反應:N2(g)+3H2(g)?2NH3(g),測得其中N2(g)物質的量隨時間變化如圖.
一定溫度下,在體積為2L的恒容密閉容器中充入1mol N2和3mol H2,一定條件下發生反應:N2(g)+3H2(g)?2NH3(g),測得其中N2(g)物質的量隨時間變化如圖.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 濃硫酸和濃硝酸加水稀釋后都能與金屬銅反應 | |
| B. | 濃硫酸和濃硝酸都不能用來直接跟鋅粒反應制氫氣 | |
| C. | 濃硫酸和濃硝酸在常溫下都能用金屬鋁制容器盛放 | |
| D. | 濃硫酸和濃硝酸都能與單質碳反應 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com