
分析 (1)已知:①CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ•mol-1
②N2(g)+O2(g)═2NO(g)△H=+180kJ•mol-1
根據蓋斯定律:①-2×②得CH4(g)+4NO(g)═CO2(g)+2N2(g)+2H2O(l),據此計算;
(2)①依據影響化學反應速率和化學平衡的因素分析判斷;
②依據反應自發進行的條件是△H-T△S<0分析判斷;
③在汽車尾氣系統中安裝催化轉化器可將CO和NO轉化為氮氣和二氧化碳;
(3)該反應是反應前后氣體體積減小的、放熱的可逆反應,要提高二氧化氮的轉化率,只要改變條件使化學平衡向正反應方向移動即可;
根據平衡常數表達式結合三行式來計算物質的平衡濃度.
解答 解:(1)已知:①CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ•mol-1,②N2(g)+O2(g)═2NO(g)△H=+180kJ•mol-1
根據蓋斯定律:①-2×②得CH4(g)+4NO(g)═CO2(g)+2N2(g)+2H2O(l),△H=-890.3kJ•mol-1-2×(+180kJ•mol-1)=-1250.3 kJ•mol-1,
故答案為:-1250.3kJ/mol;
(2)①N2(g)+O2(g)═2NO(g)△H>0,反應時氣體體積不變的吸熱反應,溫度升高,反應速率加快,平衡右移,單位時間內NO排放量越大;
故答案為:溫度升高,反應速率加快;溫度升高,有利于平衡反應正向進行;
②2CO(g)=2C(s)+O2(g)△H>0,反應是焓變增大,熵變減小的反應,△H>0,△S<0,則△H-T△S>0,反應任何溫度下都不能自發進行;
故答案為:否,該反應是焓增、熵減的反應,任何溫度下均不能自發進行;
③在汽車尾氣系統中安裝催化轉化器可減少CO和NO的污染,生成產物為二氧化氮和氮氣,反應的化學方程式為:2CO+2NO$\frac{\underline{\;催化劑\;}}{\;}$2CO2+N2,
故答案為:2CO+2NO$\frac{\underline{\;催化劑\;}}{\;}$2CO2+N2;
(3)該反應是反應前后氣體體積減小的、放熱的可逆反應,要使該反應向正反應方向移動,可改變反應物的濃度、體系的壓強、溫度等.
a.減小N02的濃度,平衡向逆反應方向移動,N02的轉化率降低,故a錯誤;
b.降低溫度,平衡向正反應方向移動,N02的轉化率提高,故b正確;
c.增加N02的濃度,平衡向正反應方向移動,且體系壓強增大,也利于反應向正反應方向移動,故c正確;
c.升高溫度,平衡向逆反應方向移動,N02的轉化率降低,故c錯誤;
根據題意知平衡時:c(N2O4)=0.0120mol/L,設c(NO2)=xmol/L,則 K=$\frac{0.012}{{x}^{2}}$=$\frac{40}{3}$,解得:x=0.030mol/L,
故答案為:bc;c(NO2)=0.030mol/L.
點評 本題考查較為綜合,涉及化學平衡計算、反應熱與焓變、氮的氧化物性質應用等知識,題目難度中等,注意掌握蓋斯定律的內容及應用方法,明確化學平衡常數的概念及表達式,試題培養了學生的分析、理解能力及化學計算能力.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 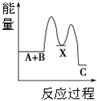 反應A+B→C(△H<0)分兩步進行:①A+B→X(△H>0),②X→C(△H<0),圖表示總反應過程中能量變化 | |
| B. | 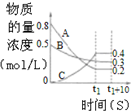 圖表示反應的化學方程式為3A+B═2C | |
| C. | 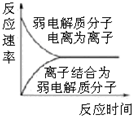 圖表示弱電解質在水中建立電離平衡的過程 | |
| D. | 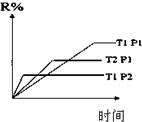 圖表示反應M(g)+N(g)?R(g)+2L(?)是放熱反應且L是氣體 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
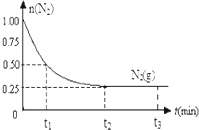 一定溫度下,在體積為2L的恒容密閉容器中充入1mol N2和3mol H2,一定條件下發生反應:N2(g)+3H2(g)?2NH3(g),測得其中N2(g)物質的量隨時間變化如圖.
一定溫度下,在體積為2L的恒容密閉容器中充入1mol N2和3mol H2,一定條件下發生反應:N2(g)+3H2(g)?2NH3(g),測得其中N2(g)物質的量隨時間變化如圖.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | c(I-)=0.1mol•L-1的溶液中:K+、Na+、SO42-、ClO- | |
| B. | 使甲基橙變紅色的溶液中:K+、NH4+、HCO3-、Cl- | |
| C. | 與Al反應能放出大量H2的溶液中:Cl-、Na+、NO3-、Fe2+ | |
| D. | 由水電離出的c(OH-)=1×10-10mol.L-1的溶液中:Ba2+、K+、NO3-、Cl- |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com