

分析 (1)根據蓋斯定律:反應②-反應①=反應③,反應熱也進行相應的計算;
(2)化學平衡常數指可逆反應得到平衡時,各生成物濃度的化學計量數次冪的乘積除以各反應物濃度的化學計量數次冪的乘積所得的比值;
化學平衡常數只受溫度影響,根據溫度對平衡移動的影響,進而判斷溫度對平衡常數影響;
(3)由圖可知,壓強一定時,隨溫度的升高,CO的轉化率降低,根據升高溫度對反應①、③的影響,進行分析CO轉化率變化原因;
相同溫度下,反應③前后氣體分子數不變,壓強改變不影響其平衡移動,反應①正反應為氣體分子式減小的反應,增大壓強,有利于平衡向正反應方向移動,CO的轉化率增大.
解答 解:(1)①CO(g)+2H2(g)═CH3OH(g)△H1=-99kJ.mol-1
②CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H2=-58kJ.mol-1
根據蓋斯定律:反應②-反應①=反應③,故△H3=△H2-△H1=-58kJ.mol-1-(-99kJ.mol-1)=+41kJ.mol-1,
故答案為:+41;
(2)反應①CO(g)+2H2(g)?CH3OH(g)的平衡常數表達式K=$\frac{c(C{H}_{3}OH)}{c(CO){c}^{2}({H}_{2})}$;
反應①正反應為放熱反應,升高溫度,平衡向逆反應方向移動,平衡常數減小,曲線a正確反映平衡常數K隨溫度變化關系,
故答案為:$\frac{c(C{H}_{3}OH)}{c(CO){c}^{2}({H}_{2})}$;a;反應①正反應為放熱反應,平衡常數隨溫度升高而減小;
(3)由圖可知,壓強一定時,隨溫度的升高,CO的轉化率減小,反應①正反應為放熱反應,升高溫度,平衡向逆反應方向移動,平衡體系中CO的量增大,反應③為吸熱反應,升高溫度,平衡向正反應方向移動,又使平衡體系中CO的增大,總結果,隨溫度升高,CO的轉化率減小;
相同溫度下,反應③前后氣體分子數不變,壓強改變不影響其平衡移動,反應①正反應為氣體分子數減小的反應,增大壓強,有利于平衡向正反應方向移動,CO的轉化率增大,故增大壓強有利于CO的轉化率升高,故壓強:P1>P2>P3,
故答案為:減小;升高溫度時,反應①為放熱反應,平衡向向左移動,反應③為吸熱反應,平衡向右移動,使得體系中CO的量增大,CO的轉化率降低;
P3>P2>P1;相同溫度下,由于反應①為氣體分子數減小的反應,加壓有利于提升CO的轉化率;而反應③為氣體分子數不變的反應,產生CO的量不受壓強影響,故增大壓強時,有利于CO的轉化率升高.
點評 本題考查反應熱有關計算、平衡常數及其影響因素、化學平衡的影響因素、化學平衡圖象綜合應用等,側重考查學生分析計算能力,需要學生具備扎實的基礎,難度中等.


科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2:3:2 | B. | 2:2:3 | C. | 1:3:4 | D. | 3:1:2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
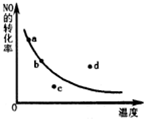 已知反應:2NO+O2?2NO2△H<0,如圖曲線是表示其他條件一定時,反應中NO最大轉化率與溫度的關系曲線,圖中標有a、b、c、d四點,其中表示未達到平衡狀態,且v(正)<v(逆)的點是( )
已知反應:2NO+O2?2NO2△H<0,如圖曲線是表示其他條件一定時,反應中NO最大轉化率與溫度的關系曲線,圖中標有a、b、c、d四點,其中表示未達到平衡狀態,且v(正)<v(逆)的點是( )| A. | a點 | B. | b點 | C. | c點 | D. | d點 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 操作 | 現象 |
| 點燃酒精燈, 加熱至170℃ | a.A中燒瓶內液體漸漸變黑 b.B內氣泡連續冒出,溶液逐漸褪色 |
| … | |
| 實驗完畢 | c.A中燒瓶內附著少量黑色顆粒狀物,有刺激性氣味逸出 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 苯、乙醇、四氯化碳 | B. | 苯、溴苯、四氯化碳 | ||
| C. | 硝基苯、乙醇、四氯化碳 | D. | 硝基苯、乙醇、乙酸 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 1 mol N2(g)和 1 mol O2(g)反應放出的能量為 180 kJ | |
| B. | 1 mol N2(g)和 1 mol O2(g)具有的總能量小于 2 mol NO(g)具有的總能量 | |
| C. | 通常情況下,N2(g)和 O2(g)混合能直接生成 NO(g) | |
| D. | NO 是一種酸性氧化物,能與 NaOH 溶液反應生成鹽和水 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | a=4 | |
| B. | 每有3 mol Fe2+參加反應,反應中轉移的電子總數為5 mol | |
| C. | 將Y均勻分散到水中形成的體系具有丁達爾效應 | |
| D. | S2O32-是還原劑 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com