

分析 (1)在壓強相同的條件下,T1對應的吸氫量大,也就是T2→T1,平衡正向移動,而正反應是放熱反應,平衡常數是溫度的函數,溫度不變平衡常數不變,結合表達式分析求解;
(2)①b極質量增加,則b是陰極,所以a是陽極,c是負極、d是正極,通入氫氣的電極是負極,所以A是氫氣、B是氧氣和二氧化碳,d電極上氧氣得電子和二氧化碳反應生成碳酸根離子;
②若用該裝置電解精煉銅,b是陰極,陰極上發生還原反應得到純銅;如果是電鍍池,鐵是陰極,所以陽極為鉑;若電鍍量較大,需要經常補充或更換的是電解質溶液;
(3)根據蓋斯定律①N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,②2H2(g)+O2(g)=2H2O(l)△H=-572kJ•mol-1,根據蓋斯定律,由②×3-①×2來解答;
(4)①根據化學平衡常數表達式K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2}){c}^{3}({H}_{2})}$來計算;②根據v=$\frac{△c}{△t}$計算.
解答 解:(1)在壓強相同的條件下,T1對應的吸氫量大,也就是T2→T1,平衡正向移動,而正反應是放熱反應,所以T2→T1,是降溫,所以T2>T1,
a.T1<T2,故a錯誤;
b.增大氫氣壓強,反應速率加快,氫氣的吸收速率加快,故b正確;
c.M為固體,增大M的量,濃度不變,上述平衡不移動,故c錯誤;
d.在恒溫、恒容容器中,達平衡后充入H2,K=cx(H2),而平衡常數是溫度的函數,溫度不變,濃度不變,而體積不變,所以物質的量不變,壓強不變,故d錯誤;
故答案為:b;
(2)①b極質量增加,則b是陰極,所以a是陽極,c是負極、d是正極,通入氫氣的電極是負極,所以A是氫氣、B是氧氣和二氧化碳,d電極上氧氣得電子和二氧化碳反應生成碳酸根離子,電極反應式為O2+4e-+2CO2=2CO32-,
故答案為:O2+4e-+2CO2=2CO32-;
②若用該裝置電解精煉銅,b是陰極,陰極上發生還原反應得到純銅;如果是電鍍池,鐵是陰極,所以陽極為鉑;若電鍍量較大,需要經常補充或更換的是CuSO4溶液,故答案為:精銅;a;CuSO4溶液;
(3)①N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1
②2H2(g)+O2(g)=2H2O(l)△H=-572kJ•mol-1
根據蓋斯定律,由②×3-①×2得:4NH3(g)+3O2(g)=2N2(g)+6H2O(l)△H=-1531.2 kJ•mol-1
故答案為:4NH3(g)+3O2(g)=2N2(g)+6H2O(l)△H=-1531.2 kJ•mol-1;
(4)N2 +3H2?2NH3,
開始(mol):1 3 0
變化(mol):α 3α 2α
平衡(mol):1-α 3-3α 2α
①該反應的平衡常數K=$\frac{(\frac{2a}{10})^{2}}{\frac{1-a}{10}×(\frac{3-3a}{10})^{3}}$=$\frac{400{a}^{2}}{27(1-a)^{4}}$,故答案為:$\frac{400{a}^{2}}{27(1-a)^{4}}$;
②從反應開始到平衡時N2的消耗速率v(N2)=$\frac{△c}{△t}$=$\frac{\frac{a}{10}}{5min}$=0.02αmo1•L-1•min-1,故答案為:0.02α.
點評 本題是道綜合題,三段式法對化學反應進行計算,注意化學平衡常數、轉化率等知識的運用,難度不大,涉及知識點較多,注意對應知識的積累.


 一線名師權威作業本系列答案
一線名師權威作業本系列答案科目:高中化學 來源: 題型:選擇題
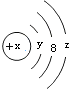
| A. | Y=2 | B. | 若X=14,它的氫化物的化學式為H2X | ||
| C. | 若X=18,則Z=8 | D. | 若X=17,它的氧化物化學式為W2O7 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
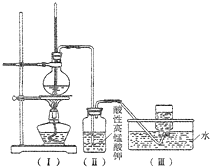 如圖,在實驗室里,通常利用濃硫酸與乙醇混合加熱制乙烯,加熱一段時間后溶液中出現棕色、黑色現象.過一段時間后,發現硫酸酸化的高錳酸鉀溶液褪色.甲同學認為酸性高錳酸鉀溶液褪色,能證明乙烯被酸性高錳酸鉀溶液氧化了;乙同學認為酸性高錳酸鉀溶液褪色,不能證明乙烯被酸性高錳酸鉀溶液氧化了.
如圖,在實驗室里,通常利用濃硫酸與乙醇混合加熱制乙烯,加熱一段時間后溶液中出現棕色、黑色現象.過一段時間后,發現硫酸酸化的高錳酸鉀溶液褪色.甲同學認為酸性高錳酸鉀溶液褪色,能證明乙烯被酸性高錳酸鉀溶液氧化了;乙同學認為酸性高錳酸鉀溶液褪色,不能證明乙烯被酸性高錳酸鉀溶液氧化了.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
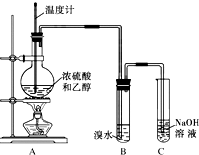 為探究乙烯的制取及乙烯和溴水反應的有關問題,甲、乙、丙三同學進行了如下實驗活動,請你參與他們的活動并回答相關問題.
為探究乙烯的制取及乙烯和溴水反應的有關問題,甲、乙、丙三同學進行了如下實驗活動,請你參與他們的活動并回答相關問題.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 該反應是放熱反應 | |
| B. | 斷裂2 mol A-B 鍵需要吸收y kJ的能量 | |
| C. | 斷裂1 mol A-A 鍵和1 mol B-B 鍵放出x kJ能量 | |
| D. | 1 mol A2和1 mol B2的總能量高于2 mol AB的總能量 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 如圖裝置,用電化學原理制備硫酸,并電解500mL 0.2mol?L-1AgNO3溶液.請回答下列問題:
如圖裝置,用電化學原理制備硫酸,并電解500mL 0.2mol?L-1AgNO3溶液.請回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com