
 W、X、Y、Z、M、G六種主族元素分屬三個短周期,且原子序數依次增大.Y是地殼中含量最多的元素;M與Y同主族;G與Z形成的化合物是廚房常用的調味品;X的簡單氣態氫化物水溶液呈堿性.請回答下列問題:
W、X、Y、Z、M、G六種主族元素分屬三個短周期,且原子序數依次增大.Y是地殼中含量最多的元素;M與Y同主族;G與Z形成的化合物是廚房常用的調味品;X的簡單氣態氫化物水溶液呈堿性.請回答下列問題: ,W、Y、Z、M、G形成的簡單離子的半徑大小順序是S2->Cl->O2->Na+>H+(用相應的離子符號表示).
,W、Y、Z、M、G形成的簡單離子的半徑大小順序是S2->Cl->O2->Na+>H+(用相應的離子符號表示).分析 W、X、Y、Z、M、G六種元素分屬三個短周期,原子序數依次增大,則W應為H元素,Y是地殼中含量最多的元素,則Y為O元素;M與Y同主族,則M為S元素,故G為Cl元素;G與Z形成的化合物是廚房常用的調味品,則Z為Na;X的簡單氣態氫化物水溶液呈堿性,則X為N元素.
(1)主族元素周期數=電子層、主族族序數=最外層電子數;X的簡單氣態氫化物為NH3,分子中N原子與H原子之間形成1對共用電子對;離子核外電子層數越多,離子半徑越大,核外電子排布相同的離子,核電荷數越大離子半徑越小;
(2)元素非金屬性越強,氫化物越越穩定;
(3)由 H、O、Na、S組成的兩種鹽(均含有以上四種元素)的溶液反應可產生SO2氣體,應是亞硫酸氫鈉與硫酸氫鈉反應生成硫酸鈉、二氧化硫與水;
(4)①A為電解池陰極,發生還原反應,水放出生成氫氣與氫氧根離子;
②B電極為電解池陽極,發生氧化反應,氯離子放電生成氯氣,用濕潤的淀粉KI試紙檢驗;
(5)A.均屬于分子晶體,相對分子質量越大沸點越大;
故A錯誤;
B.1molN4氣體中含有6molN-N鍵,可生成2molN2,形成2molN≡N鍵,反應熱=反應物總鍵能-生成物總鍵能,據此計算判斷;
C.X4與X2都由同種元素構成的不同單質,二者為同素異形體;
(6)用N2H4作為火箭發動機的燃料,NO2為氧化劑,反應生成N2和水蒸氣,反應方程式為:2N2H4+2NO2═3N2+4H2O,計算生成4mol水蒸氣放出的熱量,注明聚集狀態與反應熱書寫熱化學方程式;
16g N2H4(g)的物質的量為$\frac{16g}{32g/mol}$=0.5mol,根據方程式計算出生成氣態水放出的熱量,氣態水轉化為液態水也放出熱量,進而計算生成液態水放出的熱量;
用N2H4、氧氣與KOH溶液組成堿性燃料電池,負極上N2H4失電子發生氧化反應,堿性條件下生成氮氣與水,電解質溶液中陰離子向負極移動.
解答 解:W、X、Y、Z、M、G六種元素分屬三個短周期,原子序數依次增大,則W應為H元素,Y是地殼中含量最多的元素,則Y為O元素;M與Y同主族,則M為S元素,故G為Cl元素;G與Z形成的化合物是廚房常用的調味品,則Z為Na;X的簡單氣態氫化物水溶液呈堿性,則X為N元素.
(1)M為S元素,原子核外有3個電子層,最外層電子數為6,故其處于第三周期ⅥA族;X的簡單氣態氫化物為NH3,電子式為 ;離子核外電子層數越多,離子半徑越大,核外電子排布相同的離子,核電荷數越大離子半徑越小,故離子半徑:為S2->Cl->O2->Na+>H+,
;離子核外電子層數越多,離子半徑越大,核外電子排布相同的離子,核電荷數越大離子半徑越小,故離子半徑:為S2->Cl->O2->Na+>H+,
故答案為:第三周期ⅥA族; ;S2->Cl->O2->Na+>H+;
;S2->Cl->O2->Na+>H+;
(2)由于非金屬性O>S,故氫化物穩定性H2O>H2S,
故答案為:H2O;O的非金屬性大于S;
(3)由 H、O、Na、S組成的兩種鹽(均含有以上四種元素)的溶液反應可產生SO2氣體,應是亞硫酸氫鈉與硫酸氫鈉反應生成硫酸鈉、二氧化硫與水,反應離子方程式為:HSO3-+H+═H2O+SO2↑,
故答案為:HSO3-+H+═H2O+SO2↑;
(4)如圖1,A、B兩極均為惰性電極,a是NaCl飽和溶液,實驗開始時,同時在兩邊各滴入幾滴酚酞試液,則:①A為電解池陰極,發生還原反應,水放出生成氫氣與氫氧根離子,電極反應式為:2H2O+2e-═H2↑+2OH-,現象為:有氣泡產生,且溶液呈紅色,
故答案為:2H2O+2e-═H2↑+2OH-;有氣泡產生,且溶液呈紅色;
②B電極為電解池陽極,發生氧化反應,氯離子放電生成氯氣,電極反應式為:2Cl--2e-═Cl2↑,用濕潤的淀粉KI試紙,試紙變藍,
故答案為:2Cl--2e-═Cl2↑;用濕潤的淀粉KI試紙,試紙變藍;
(5)A.X4沸點比P4(白磷)低,屬于分子晶體,故A錯誤;
B.1molN4氣體中含有6molN-N鍵,可生成2molN2,形成2molN≡N鍵,則1moN4氣體轉變為N2化學鍵斷裂斷裂吸收的熱量為6×167KJ=1002KJ,形成化學鍵放出的熱量為2×942kJ=1884KJ,所以反應放熱,放出的熱量為1884KJ-1002KJ=882KJ,故B正確;
C.X4與X2都由同種元素構成的不同單質,為同素異形體,故C正確.
故答案為:BC;
(6)用N2H4作為火箭發動機的燃料,NO2為氧化劑,反應生成N2和水蒸氣,反應方程式為:2N2H4+2NO2═3N2+4H2O,已知生成1mol水蒸氣時放熱284kJ,則反應的熱化學方程式為:2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g)△H=-1136kJ/mol,
16g N2H4(g)的物質的量為$\frac{16g}{32g/mol}$=0.5mol,由方程式可知生成水為0.5mol×2=1mol,已知H2O(l)═H2O(g)△H=+44kJ/mol,與NO2反應生成液態水時放出的熱量是1136kJ/mol×$\frac{1}{4}$+1mol×44kJ/mol=328kJ,
用N2H4、氧氣與KOH溶液組成堿性燃料電池,負極上N2H4失電子發生氧化反應,電極反應式為:N2H4-4e-+4OH-═N2↑+4H2O,電解質溶液中OH-離子向負極移動
故答案為:2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g)△H=-1136kJ/mol;328;2H4-4e-+4OH-═N2↑+4H2O;負.
點評 本題考查結構性質位置關系應用,涉及半徑比較、元素周期律、原電池、電解池、熱化學方程式書寫及反應熱計算、元素化合物推斷等,推斷元素是解題關鍵,注意對基礎知識的理解掌握,難度中等.


 高效智能課時作業系列答案
高效智能課時作業系列答案 捷徑訓練檢測卷系列答案
捷徑訓練檢測卷系列答案科目:高中化學 來源: 題型:解答題

| 溫度/℃ | 200℃ | 250℃ | 300℃ |
| 平衡常數/(mol•L-1)2 | K1 | K2 | 80 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 原子半徑:Na<Mg<Al | B. | 熱穩定性:HCl>H2S>PH3 | ||
| C. | 酸性強弱:H2SiO4<H2CO3<H2SO4 | D. | 熔點:NaCl>Na>CO2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 序號 | 事實 | 推論 |
| A | 與冷水反應,Na比Mg劇烈 | 金屬性:Na>Mg |
| B | Ca(OH)2的堿性強于Mg(OH)2 | 金屬性:Ca>Mg |
| C | SO2與NaHCO3溶液反應生成CO2 | 非金屬性:S>C |
| D | t℃時,A2+H2?2HA K=5.6×107 B2+H2?2HB K=43 | 非金屬性:A>B |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
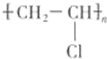 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
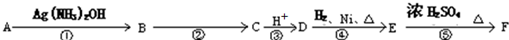
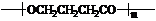 +nH2O.
+nH2O.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 分子中的3個碳原子在一條直線上 | |
| B. | 在光照條件下能和氯氣發生取代反應 | |
| C. | 分子中含有極性鍵和非極性鍵 | |
| D. | 丙烷和丁烷互為同系物 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com