
分析 (1)平衡常數為生成物離子(或分子)濃度系數次冪之積除以反應物離子(或分子)濃度系數次冪之積反應;
(2)Mg(OH)2的溶度積為鎂離子濃度與氫氧根離子濃度平方的乘積;
(3)醋酸是弱電解質,加水稀釋醋酸溶液,促進醋酸電離,醋酸電離產生的醋酸根離子和氫離子數目增多濃度減小,根據醋酸的電離程度確定溶液中微粒個數變化.
解答 解:(1)平衡常數為生成物離子(或分子)濃度系數次冪之積除以反應物離子(或分子)濃度系數次冪之積反應,則反應Cl2+H2O?H++Clˉ+HClO其化學平衡常數K的表達式為:K=$\frac{c({H}^{+})•c(C{l}^{-})•c(HClO)}{c(C{l}_{2})}$;
故答案為:K=$\frac{c({H}^{+})•c(C{l}^{-})•c(HClO)}{c(C{l}_{2})}$;
(2)Mg(OH)2的溶度積為鎂離子濃度與氫氧根離子濃度平方的乘積,則Mg(OH)2的溶度積表達式為:Ksp=c(Mg2+)•c2(OH-);
故答案為:Ksp=c(Mg2+)•c2(OH-);
(3)A、醋酸是弱電解質,加水稀釋醋酸溶液,促進醋酸電離,醋酸電離產生的醋酸根離子和氫離子數目增多,故A錯誤;
B、加水稀釋,促進電離,但離子濃度降低,故B錯誤;
C、$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$=$\frac{{K}_{a}}{{K}_{W}}$,電離平衡常數和水的離子積常數不變,所以其不變,故C正確;
D、醋酸電離產生的醋酸根離子和氫離子數目增多,水電離的氫離子數目增大,則$\frac{c(C{H}_{3}CO{O}^{-})}{c({H}^{+})}$減小,故D正確;
故答案為:CD.
點評 本題考查了平衡常數的表達式、溶度積常數的表達式、弱電解質溶液加水稀釋過程中離子濃度的變化,注意醋酸在稀釋時電離產生的醋酸根離子和氫離子數目增多濃度減小,題目難度不大.


科目:高中化學 來源: 題型:填空題
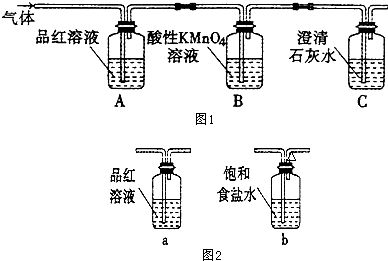
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 (1)T℃時,A氣體與B氣體反應生成C氣體,反應過程中A、B、C濃度變化如圖所示,根據圖示可知:A與B反應生成C的化學方程式為A(g)+3B(g)?2C(g).
(1)T℃時,A氣體與B氣體反應生成C氣體,反應過程中A、B、C濃度變化如圖所示,根據圖示可知:A與B反應生成C的化學方程式為A(g)+3B(g)?2C(g).| 時間/s n/mol | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 一定條件下,Cl2可在甲苯的苯環或側鏈上發生取代反應 | |
| B. | 苯酚鈉溶液中通入少量CO2,可以生成苯酚和碳酸鈉 | |
| C. | 乙烷和丙烯的物質的量共1 mol,完全燃燒生成3 mol H2O | |
| D. | 光照下2,2─二甲基丙烷與Br2反應,其一溴取代物只有一種 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 化合物A、B可合成熒光“魔棒”中產生能量的物質之一(CPPO).
化合物A、B可合成熒光“魔棒”中產生能量的物質之一(CPPO).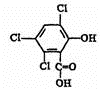 .
. .
.查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 W、X、Y、Z、M、G六種主族元素分屬三個短周期,且原子序數依次增大.Y是地殼中含量最多的元素;M與Y同主族;G與Z形成的化合物是廚房常用的調味品;X的簡單氣態氫化物水溶液呈堿性.請回答下列問題:
W、X、Y、Z、M、G六種主族元素分屬三個短周期,且原子序數依次增大.Y是地殼中含量最多的元素;M與Y同主族;G與Z形成的化合物是廚房常用的調味品;X的簡單氣態氫化物水溶液呈堿性.請回答下列問題: ,W、Y、Z、M、G形成的簡單離子的半徑大小順序是S2->Cl->O2->Na+>H+(用相應的離子符號表示).
,W、Y、Z、M、G形成的簡單離子的半徑大小順序是S2->Cl->O2->Na+>H+(用相應的離子符號表示).查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com