
| 電離能(KJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15399 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
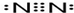 .
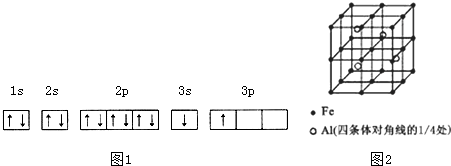
.分析 (1)①由電子軌道排布圖可知,3s能級未填滿就填充3p能級,而3s能級能量比3p能級低;
由表中電離能可知,二者第三電離能都劇增,原子最外層電子數為2,都為短周期元素,同主族自上而下第一電離能降低,故A為鈹、B為Mg,鎂價層電子排布為3s2;
②BeCl2分子中Be的成2個σ鍵,Be原子價層電子對個數是2且不含孤電子對,根據價層電子對互斥理論判斷Be原子雜化方式及微粒空間構型;
(2)①以體心立方堆積形成的金屬鐵中,該晶胞中8個頂點及體心上分別含有1個Fe原子;
②原子個數相等且價電子數相等的微粒互為等電子體;
③[Fe(CN)6]4-中存在配位鍵、極性鍵,共價單鍵為σ鍵,共價三鍵中存在σ鍵和π鍵;
(3)①該晶胞中Fe原子個數=8×$\frac{1}{8}$+6×$\frac{1}{2}$+1+12×$\frac{1}{4}$=8,Al原子個數為4,所以Fe、Al原子個數之比=8:4=2:1;
②該晶胞棱長=$\root{3}{\frac{\frac{M}{{N}_{A}}×4}{ρ}}$cm,此合金中最近的兩個Fe原子之間的距離為晶胞棱長的一半.
解答 解:(1)①由圖1電子軌道排布圖可知,3s能級未填滿就填充3p能級,3s能級能量比3p能級低,所以違背能量最低原理;
由表中電離能可知,二者第三電離能都劇增,原子最外層電子數為2,都為短周期元素,同主族自上而下第一電離能降低,故A為鈹、B為Mg,鎂價層電子排布為3s2,處于周期表中s區,
故答案為:能量最低原理;s;
②BeCl2分子中Be的成2個σ鍵,價層電子對個數是2,所以采取sp雜化,為直線形,
故答案為:sp雜化;直線形;
(2)①以體心立方堆積形成的金屬鐵中,該晶胞中8個頂點及體心上分別含有1個Fe原子,所以其配位數是8,故答案為:8;
②原子個數相等且價電子數相等的微粒互為等電子體,氫氰根離子中原子個數是2價電子數是10,與氮氣互為等電子體,氮氣分子中氮原子之間共用3對電子,其電子式為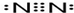 ,故答案為:
,故答案為: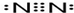 ;
;
③[Fe(CN)6]4-中存在配位鍵、極性鍵,共價單鍵為σ鍵,共價三鍵中存在σ鍵和π鍵,該微粒中碳原子和N原子之間存在配位鍵,C、N原子之間存在極性共價鍵及σ鍵和π鍵,所以不存在非極性鍵,故選B;
(3)①該晶胞中Fe原子個數=8×$\frac{1}{8}$+6×$\frac{1}{2}$+1+12×$\frac{1}{4}$=8,Al原子個數為4,所以Fe、Al原子個數之比=8:4=2:1,所以其化學式為Fe2Al,故答案為:Fe2Al;
②該晶胞棱長=$\root{3}{\frac{\frac{M}{{N}_{A}}×4}{ρ}}$cm,此合金中最近的兩個Fe原子之間的距離為晶胞棱長的一半=$\frac{1}{2}$×$\root{3}{\frac{\frac{M}{{N}_{A}}×4}{ρ}}$cm=$\frac{1}{2}$×$\root{3}{\frac{\frac{139}{{N}_{A}}×4}{ρ}}$cm=$\root{3}{\frac{139}{2ρ{N}_{A}}}$cm,
故答案為:$\root{3}{\frac{139}{2ρ{N}_{A}}}$.
點評 本題考查物質結構和性質,為高頻考點,涉及晶胞計算、等電子體、化學鍵判斷、微粒空間構型等知識點,側考查學生知識綜合應用及空間想象、計算能力,難點是晶胞計算,注意:配位鍵屬于共價鍵.


科目:高中化學 來源: 題型:實驗題
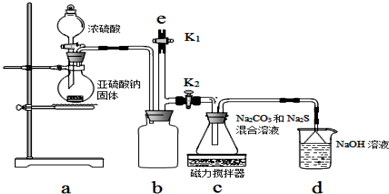
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 同族元素,隨著核外電子層數的增加,I1逐漸增大 | |
| B. | 通常情況下,對于同一種元素的原子,其電離能I1<I2<I3 | |
| C. | 同周期元素,總體變化趨勢是隨著核電荷數的增加,I1增大 | |
| D. | 通常情況下,電離能越小,元素的金屬性越強 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
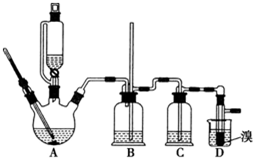 實驗室制備 1,2-二溴乙烷的反應原理如下:CH3CH2OH$→_{1700℃}^{H_{2}SO_{4}(濃)}$CH2=CH
實驗室制備 1,2-二溴乙烷的反應原理如下:CH3CH2OH$→_{1700℃}^{H_{2}SO_{4}(濃)}$CH2=CH| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 狀態 | 無色液體 | 無色液體 | 無色液體 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸點/℃ | 78.5 | 132 | 34.6 |
| 熔點/℃ | -130 | 9 | -116 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 稱量樣品→加熱→冷卻→稱量CuO | |
| B. | 稱量樣品→加熱→用已知質量的無水氯化鈣吸收水蒸氣并稱量 | |
| C. | 稱量樣品→加熱→冷卻→稱量Cu(NO3)2 | |
| D. | 稱量樣品→加NaOH→過濾→加熱→冷卻→稱量CuO |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 制乙烯時,用排水法或向上排空氣法收集氣體 | |
| B. | 制氯氣時,用飽和NaHCO3溶液和濃硫酸凈化氣體 | |
| C. | 制氧氣時,用Na2O2或H2O2作反應物可選擇相同的氣體發生裝置 | |
| D. | 制二氧化氮時,用水或NaOH溶液吸收尾氣 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 不變 | B. | 增大 | C. | 減小 | D. | 無法判斷 |
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
 某化學活動小組設計實驗(裝置如圖)驗證氯、溴、碘及其化合物的有關物質.在硬質玻璃管中的A、B、C三處依次放置濕潤的藍色石蕊試紙、浸有NaBr溶液的棉球、浸有淀粉-KI溶液的棉球(如圖所示),由左端通入足量氯氣,回答下列問題:
某化學活動小組設計實驗(裝置如圖)驗證氯、溴、碘及其化合物的有關物質.在硬質玻璃管中的A、B、C三處依次放置濕潤的藍色石蕊試紙、浸有NaBr溶液的棉球、浸有淀粉-KI溶液的棉球(如圖所示),由左端通入足量氯氣,回答下列問題:查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com