
| 實驗操作 | 實驗現象及結論 |
| ①取粗產品于試管中,加入1.0 mol•L-1Na2CO3溶液,酯溶解度減小振蕩分層,用分液漏斗分液,得到水層加入0.1 mol•L-1BaCl2溶液 | 白色沉淀生成,說明含有硫酸 |
| ②取①反應后的溶液于試管中,加入1 mol•L-1HCl溶液 | 出現白色晶體,證明含有苯甲酸 |
分析 檢驗方法為:可以取少量于試管中,加入碳酸鈉溶液,降低甲酸甲酯溶解度,苯甲酸和硫酸全部反應生成苯甲酸鈉和硫酸鈉溶液,分液漏斗分液后得到苯甲酸鈉和硫酸鈉溶液,加入氯化鋇溶液,出現白色沉淀硫酸鋇,證明含有硫酸,再取少量上述反應后的溶液,加入鹽酸生成白色晶體,證明含有苯甲酸.
解答 解:某甲酸甲酯粗產品中往往含有少量甲醇、硫酸、苯甲酸、和水等,某同學為了檢驗產品中的苯甲酸和硫酸,可以取少量于試管中,加入碳酸鈉溶液,降低甲酸甲酯溶解度,苯甲酸和硫酸全部反應生成苯甲酸鈉和硫酸鈉溶液,分液漏斗分液后得到苯甲酸鈉和硫酸鈉溶液,加入氯化鋇溶液,出現白色沉淀硫酸鋇,證明含有硫酸,再取少量上述反應后的溶液,加入鹽酸生成白色晶體,證明含有苯甲酸;
故答案為:
| 實驗操作 | 實驗現象及結論 |
| ①取粗產品于試管中,加入1.0 mol•L-1Na2CO3溶液,酯溶解度減小振蕩分層,用分液漏斗分液,得到水層加入0.1 mol•L-1BaCl2溶液 | 白色沉淀生成,說明含有硫酸 |
| ②取①反應后的溶液于試管中,加入1 mol•L-1HCl溶液 | 出現白色晶體,證明含有苯甲酸 |
點評 本題考查了物質檢驗的實驗分析應用,主要是實驗現象和結論的分析判斷,掌握物質性質是解題關鍵,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 由Cl2+H2O=HCl+HClO可推出F2+H2O=HF+HFO | |
| B. | HCl的水溶液是強酸,推出HF水溶液也是強酸 | |
| C. | 由2Fe+3Cl2=2FeCl3可推出2Fe+3I2=2FeI3 | |
| D. | Na、K在屬于同一主族,化學性質相似,Na常溫下與水劇烈反應,故K常溫下也能與水劇烈反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
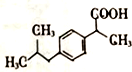

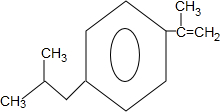 +H2O$→_{△}^{催化劑}$
+H2O$→_{△}^{催化劑}$ .
.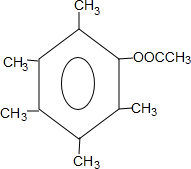 或
或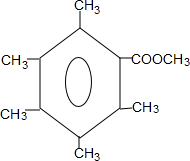 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 濃硫酸與少量銅片反應的實驗,下列是對實驗操作、實驗現象或解釋等的有關記錄,其中與事實不符或解釋不合理的是( )
濃硫酸與少量銅片反應的實驗,下列是對實驗操作、實驗現象或解釋等的有關記錄,其中與事實不符或解釋不合理的是( )| A. | 實驗開始時需給a試管稍微加熱 | |
| B. | 反應開始時銅片表面可以看到有黑色物質生成 | |
| C. | 將a試管里的溶液冷卻后注入盛有水的燒杯中,溶液呈藍色 | |
| D. | b試管中的溶液逐漸褪為無色,說明反應生成的氣體,將品紅氧化為無色 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
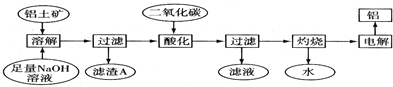
 節能減排是當下環境保護的重點.
節能減排是當下環境保護的重點.| H2O | CO | CO2 | H2 | |
| n/mol | 0.20 | 0.20 | 0 | 0 |
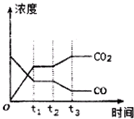
| 容器編號 | c(CO)/mol•L-1 | c(O2))/mol•L-1 | c(CO2))/mol•L-1 | v(正)和v(逆)比較 |
| Ⅰ | 2.0×10-4 | 4.0×10-4 | 4.0×10-2 | v(正)=v(逆) |
| Ⅱ | 3.0×10-4 | 4.0×10-4 | 5.0×10-2 | v(正)>v(逆) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
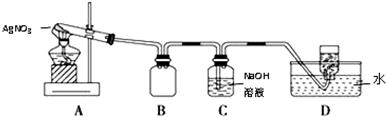
| 操作 | 現象 | 結論 |
| 取少量除盡Ag+后的溶液于試管中,加入KSCN溶液,振蕩 | 溶液變(血)紅色 | 存在Fe3+ |
| 取少量除盡Ag+后的溶液于試管中,加入1~2滴③或④(填序號)溶液,振蕩 | 紫紅色褪去或產生藍色沉淀 | 存在Fe2+ |
| 實驗編號 | 操 作 | 現 象 |
| a | 加入足量氨水,振蕩 | 黑色固體不溶解 |
| b | 加入足量稀硝酸,振蕩 | 黑色固體溶解,并有氣體產生 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com