
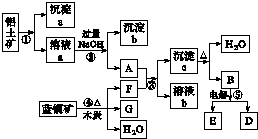
分析 鋁土礦的主要成分是Al2O3、Fe2O3、SiO2,溶液a能與氫氧化鈉溶液反應,應含有鋁離子、鐵離子,則鋁土礦加入鹽酸,溶解過濾得到沉淀a為SiO2,溶液a為氯化鋁、氯化鐵溶液,加入過量氫氧化鈉溶液,過濾得到沉淀b為Fe(OH)3,A為NaAlO2溶液,藍銅礦的主要成分是2CuCO3•Cu(OH)2,受熱易分解加入木炭還原生成產物為F為CO2,G為Cu,F+A反應生成沉淀c為Al(OH)3,溶液b為碳酸氫鈉溶液,沉淀c受熱分解得到B為Al2O3和水,氧化鋁電解得到E和D為氧氣和鋁,以此解答該題.
解答 解:鋁土礦的主要成分是Al2O3、Fe2O3、SiO2,溶液a能與氫氧化鈉溶液反應,應含有鋁離子、鐵離子,則鋁土礦加入鹽酸,溶解過濾得到沉淀a為SiO2,溶液a為氯化鋁、氯化鐵溶液,加入過量氫氧化鈉溶液,過濾得到沉淀b為Fe(OH)3,A為NaAlO2溶液,藍銅礦的主要成分是2CuCO3•Cu(OH)2,受熱易分解加入木炭還原生成產物為F為CO2,G為Cu,F+A反應生成沉淀c為Al(OH)3,溶液b為碳酸氫鈉溶液,沉淀c受熱分解得到B為Al2O3和水,氧化鋁電解得到E和D為氧氣和鋁,
(1)反應②是氫氧化鈉溶液和氯化鋁溶液反應生成偏鋁酸鈉,反應的離子方程式為:Al3++4OH-=AlO2-+2H2O,氫氧化鈉溶液和氯化鐵反應生成氫氧化鐵沉淀,反應的離子方程式為:Fe3++3OH-=Fe(OH)3↓,
故答案為:Al3++4OH-=AlO2-+2H2O、Fe3++3OH-=Fe(OH)3↓;
(2)上述分析可知a為二氧化硅化學式為SiO2,c為氫氧化鋁化學式為Al(OH)3,
故答案為:SiO2;Al(OH)3;
(3)洗滌沉淀c的實驗操作方法是:在漏斗內的沉淀上加入一定量的蒸餾水,沒過沉淀,待水自然流下,重復數次,
故答案為:在漏斗內的沉淀上加入一定量的蒸餾水,沒過沉淀,待水自然流下,重復數次;
(4)電解熔融氧化鋁得到鋁和氧氣反應的化學方程式為:2Al2O3(熔融)$\frac{\underline{\;通電\;}}{\;}$4Al+3O2↑,
故答案為:2Al2O3(熔融)$\frac{\underline{\;通電\;}}{\;}$4Al+3O2↑.
點評 本題考查了物質分離提純方法和過程分析判斷,為高考常見題型,側重于學生的分析能力和實驗能力的考查,題目主要是鋁及其化合物的性質、反應現象、反應產物、分離混合物的試劑選擇等知識點,注意把握物質的性質,題目難度中等.


 提分百分百檢測卷系列答案
提分百分百檢測卷系列答案 寶貝計劃期末沖刺奪100分系列答案
寶貝計劃期末沖刺奪100分系列答案科目:高中化學 來源: 題型:選擇題
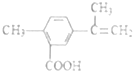
| A. | 在一定條件下,能發生取代、氧化、酯化和加聚反應 | |
| B. | 該物質分子中最多可以有11個碳原子在同一平面上 | |
| C. | 1mol該物質最多可與4molH2發生加成反應 | |
| D. | 1mol該物質完全氧化最多可消耗14mol氧氣 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用鐵制容器盛放硫酸銅溶液,容器易被腐蝕 | |
| B. | 利用催化措施,可以將汽車尾氣中的CO和NO轉化為無害氣體 | |
| C. | 防止酸雨發生的重要措施之一是使用清潔能源 | |
| D. | 氧化銅呈紅色,可作為制造陶瓷的紅色顏料 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
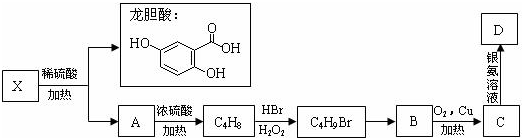
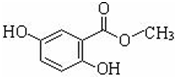 龍膽酸甲酯是制取抗心律失常藥物--氟卡尼的中間體.
龍膽酸甲酯是制取抗心律失常藥物--氟卡尼的中間體.
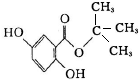

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
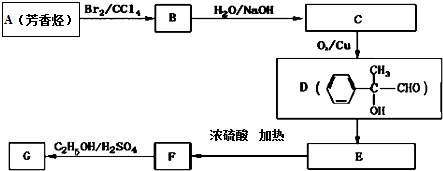
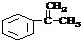 .
.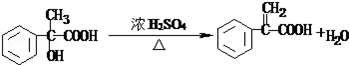 .
.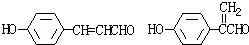 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ${\;}_{2}^{4}$He原子核內含有4個質子 | B. | ${\;}_{2}^{3}$He和${\;}_{2}^{4}$He互為同位素 | ||
| C. | ${\;}_{2}^{3}$He原子核內含有3 個中子 | D. | ${\;}_{2}^{4}$He具有較強的金屬性 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com