
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS | MnS | FeS |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 | ≥-0.42 | ≥2.5 | ≥7 | ≥7 |
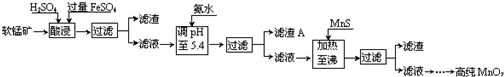
分析 軟錳礦的主要成分為MnO2,還含有Si、Fe、Al、Zn和Cu等元素的化合物,硫酸亞鐵在酸性條件下將MnO2還原為MnSO4,所以酸浸后的濾液中的金屬陽離子主要是Mn2+、Fe3+、Al3+、Cu2+、Zn2+、Fe2+等,由離子開始沉淀及沉淀完全的pH可知,調節pH為5.4,將Fe3+、Al3+沉淀,加入硫化錳將Cu2+、Zn2+沉淀,濾液為硫酸錳溶液,再通過系列變化得到高純度的二氧化錳,
(1)根據FeSO4在反應條件下將MnO2還原為MnSO4,則Fe2+被氧化為Fe3+,故酸浸時生成硫酸錳、硫酸鐵,根據元素守恒還有水生成;
(2)調節溶液的pH值要用到pH計或精密pH試紙進行測量,由題目信息可知,酸浸后的過濾液中含有Mn2+、Fe3+、Al3+、Cu2+、Zn2+、Fe2+,結合題中陽離子以氫氧化物形式完全沉淀時溶液的pH進行判斷;
(3)根據工藝流程及硫化物的Ksp判斷;
(4)由堿性鋅錳干電池的電池反應式可知,Zn作負極,MnO2得電子作正極,生成MnOOH,由電荷守恒可知還生成OH-,由元素守恒可知,還有水參與反應;
(5)從堿性鋅錳干電池的原料判斷;
(6)根據K=$\frac{c(Fe{\;}^{3+})}{{c}^{3}({H}^{+})}$=$\frac{c(Fe{\;}^{3+}){c}^{3}(O{H}^{-})}{{c}^{3}({H}^{+}){c}^{3}(O{H}^{-})}$=$\frac{K{\;}_{sp[Fe(OH){\;}_{3}]}}{{K}_{w}}$計算;
解答 解:(1)根據FeSO4在反應條件下將MnO2還原為MnSO4,Fe2+被氧化為Fe3+,故酸浸時生成硫酸錳、硫酸鐵,根據元素守恒還有水生成,反應方程式為2FeSO4+MnO2+2H2SO4=MnSO4+Fe2(SO4)3+2H2O,
故答案為:2FeSO4+MnO2+2H2SO4=MnSO4+Fe2(SO4)3+2H2O;
(2)調節溶液的pH值要用到pH計或精密pH試紙進行測量,酸浸后的過濾液中含有Mn2+、Fe3+、Al3+、Cu2+、Zn2+、Fe2+,加氨水調pH至5.4,結合題中陽離子以氫氧化物形式完全沉淀時溶液的pH可知,Fe3+、Al3+完全轉化為Fe(OH)3和Al(OH)3沉淀,其它離子不沉淀,故濾渣A的主要成分為
Fe(OH)3和Al(OH)3,
故答案為:pH計或精密pH試紙;Fe(OH)3和Al(OH)3;
(3)根據題中硫化物的Ksp可知,加入MnS是為了生成溶解度更小的CuS、ZnS而除去Cu2+、Zn2+,
故答案為:Cu2+、Zn2+;
(4)堿性鋅錳干電池中Zn作負極,則MnO2作正極得電子,其電極反應式應為MnO2+H2O+e-=MnOOH+OH-,
故答案為:MnO2+H2O+e-=MnOOH+OH-;
(5)從堿性鋅錳干電池的原料可知,其廢舊電池可回收利用的物質為鋅和MnO2,
故答案為:鋅、二氧化錳;
(6)由離子方程式可知,K=$\frac{c(Fe{\;}^{3+})}{{c}^{3}({H}^{+})}$=$\frac{c(Fe{\;}^{3+}){c}^{3}(O{H}^{-})}{{c}^{3}({H}^{+}){c}^{3}(O{H}^{-})}$=$\frac{K{\;}_{sp[Fe(OH){\;}_{3}]}}{{K}_{w}}$=$\frac{2.79×10{\;}^{-39}}{(1×1{0}^{-14})^{3}}$=2.79×103,
故答案為:2.79×103.
點評 考查學生對元素及其化合物的主要性質的掌握、書寫電極反應方程式、閱讀題目獲取新信息能力、對工藝流程的理解等,難度中等,需要學生具備扎實的基礎與綜合運用知識、信息分析解決問題能力.


科目:高中化學 來源: 題型:選擇題
| A. | 2:3 | B. | 1:2 | C. | 1:3 | D. | 3:2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
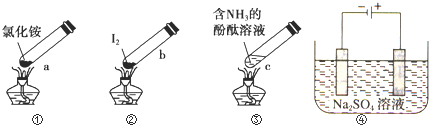
| A. | 加熱時,a上部聚集了固體NH4Cl,說明NH4Cl的熱穩定性比較好 | |
| B. | 加熱時,發現b中I2變為紫色蒸氣,在上部又聚集為紫黑色的固體 | |
| C. | 加熱時,c中溶液紅色變深,冷卻后又變淺 | |
| D. | ④左側為e右側為f,在惰性電極e和f附近分別滴加紫色石蕊試液,e電極附近呈紅色,f電極附近呈藍色 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Fe、Cu、Ag、Al、Mg | B. | Mg、Cu、Al、Ag、Fe | C. | Al、Cu、Ag、Mg、Fe | D. | Mg、Ag、Cu、Al、Fe |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題


查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 利用如圖1裝置測定中和熱的實驗步驟如下:
利用如圖1裝置測定中和熱的實驗步驟如下:| 溫度 實驗次數 | 起始溫度t1℃ | 終止溫度t2℃ | 溫度差平均值(t2-t1)℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
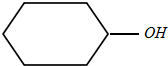 ),丙酮(CH3COCH3)和乙醛混合物1.75g,完全燃燒后,所得氣體通過P2O5吸收瓶,瓶增重1.8g,則混合物的平均相對分子質量為( )
),丙酮(CH3COCH3)和乙醛混合物1.75g,完全燃燒后,所得氣體通過P2O5吸收瓶,瓶增重1.8g,則混合物的平均相對分子質量為( )| A. | 68 | B. | 75 | C. | 80 | D. | 87.5 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 一氧化碳 | B. | 乙醇(C2H5OH) | C. | 甲酸(HCOOH) | D. | 甲醇(CH3OH) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com