


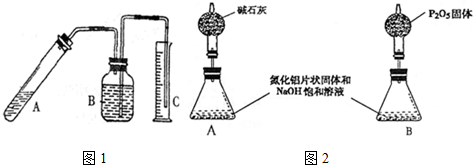
分析 I.圖B裝置進行酯化反應冷凝水下進上出;圖C裝置進行酯化反應效果更好,與冷凝與分離產物使平衡正向移動有關;
Ⅱ.(1)摩爾鹽中N為-3價,Fe為+2價,S為+6價,根據產物中化合價分析;
(2)摩爾鹽中含有的三種離子分別為亞鐵離子、硫酸根和銨根,驗證銨根需要氫氧根、驗證硫酸根需要鋇離子,依據所給試劑判斷還需要氫氧化鋇;亞鐵離子若變質應生成鐵離子,鐵離子遇KSCN變紅色,據此解答即可;
(3)①A中固體充分加熱較長時間后,通入氮氣目的是使分解生成的氣體在BC裝置中完全吸收;
②C中有白色沉淀生成,是因為SO2被雙氧水氧化成SO42-,SO42-再與Ba2+結合成沉淀BaSO4;
③高錳酸鉀具有氧化性,亞鐵離子具有還原性,高錳酸鉀溶液不褪色,說明不含有亞鐵離子,據此解答即可;
(4)分析(3)中實驗②③得出,分解產物中一定含有SO2,一定不含有FeO,據此解答即可.
解答 解:Ⅰ.冷凝管的作用是冷凝,使氣體液化回流,為增加冷凝效果,冷水從下口進入,上口放出;圖C裝置進行酯化反應效果更好,是因裝置C中既能冷凝回流又能及時分離出反應生成的水,有利于酯的生成,
故答案為:b;既能冷凝回流又能及時分離出反應生成的水,有利于酯的生成;
Ⅱ.(1)摩爾鹽中N為-3價,Fe為+2價,S為+6價,
A.Fe2O3、SO2、NH3、H2O 反應時Fe元素的化合價升高,S元素化合價降低,符合氧化還原反應規律,故A正確;
B.FeO、NH3、SO3、H2O,反應時沒有元素化合價的變化,只是發生分解反應,故B正確;
C.FeO、SO2、NH3、H2O反應時只有S元素的化合價降低,不符合氧化還原反應規律,故C錯誤;
D.Fe2O3、NH3、SO2、SO3、H2O反應時,Fe的化合價升高,S的化合價降低,符合氧化還原反應規律,故D正確,
故選C;
(2)摩爾鹽中含有的三種離子分別為亞鐵離子、硫酸根和銨根,驗證銨根需要氫氧根、驗證硫酸根需要鋇離子,依據所給試劑判斷還需要氫氧化鋇;亞鐵離子若變質應生成鐵離子,鐵離子遇KSCN變紅色,若不變紅色,說明未被氧化,
故答案為:Ba(OH)2;硫氰化鉀溶液,溶液不變紅色;
(3)①A中固體充分加熱較長時間后,產生氣體有一部分殘留在裝置中,通入氮氣可以使分解生成的氣體在B、C裝置中完全吸收,
故答案為:使分解產生的氣體在B、C中被吸收充分;
②C中有白色沉淀生成,是因為SO2被雙氧水氧化成SO42-,SO42-再與Ba2+結合成沉淀BaSO4則C中發生的反應為SO2+H2O2+Ba2+=BaSO4↓+2H+,
故答案為:SO2+H2O2+Ba2+=BaSO4↓+2H+;
③實驗驗證取A中殘留物少許加入稀硫酸溶解,再滴入KMnO4稀溶液,不褪色證明產物不含有還原性的物質,即不含有FeO,
故答案為:FeO;
(4)根據上述分析知,“摩爾鹽”分解的產物為Fe2O3、SO3、SO2、NH3 和H2O,上述猜想中一定正確的是D,故選D.
點評 本題考查了物質性質的實驗探究和實驗設計,題目涉及氧化還原反應、離子方程式的書寫、離子檢驗、實驗基本操作等,側重于考查學生對基礎知識的綜合應用能力,題目難度中等.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 陽離子 | Na+、Ba2+、NH4+ |
| 陰離子 | CH3COO-、OH-、Cl-、SO42- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | H2SO4(aq)+BaCl2(aq)═BaSO4(s)+2HCl(aq)△H<0 | |
| B. | 2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H<0 | |
| C. | 4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)△H<0 | |
| D. | 3Cu(s)+8HNO3(aq)═3Cu(NO3)2(aq)+2NO(g)+4H2O(l)△H<0 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS | MnS | FeS |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 | ≥-0.42 | ≥2.5 | ≥7 | ≥7 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | H+、Al3+、Cl-、NO3- | B. | Al3+、Mg2+、SO42-、OH- | ||
| C. | Fe2+、H+、K+、MnO4- | D. | Cu2+、H+、Cl-、HCO3- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 明礬水解形成的Al(OH)3膠體能吸附水中懸浮物,可用于水的凈化 | |
| B. | 為了防止電池中的重金屬等污染土壤和水體,應積極開發廢電池回收利用技術 | |
| C. | 工業上采用電解熔融氯化鋁制取金屬鋁 | |
| D. | 金屬的腐蝕分為化學腐蝕和電化學腐蝕,但二者的本質相同 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com