
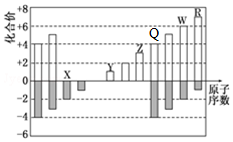
 部分短周期元素化合價與原子序數的關系可用圖表示.
部分短周期元素化合價與原子序數的關系可用圖表示.
分析 由表中化合價可知,X的化合價為-2價,沒有正化合價,故X為O元素,Y的化合價為+1價,處于ⅠA族,原子序數大于O元素,故Y為Na元素,Z為+3價,為Al元素,Q為+4價,為Si元素,W的化合價為+6、-2價,故W為S元素,R的最高正價為+7價,應為Cl元素,結合對應單質、化合物的性質以及題目要求解答該題.
解答 解:(1)由以上分析可知Q為Si,原子結構示意圖為 ,故答案為:Si;
,故答案為:Si; ;
;
(2)X、Z形成的化合物為氧化鋁,為兩性氧化物,與Y的最高價氧化物對應的水化物氫氧化鈉反應的離子方程式為Al2O3+2OH-=2AlO2-+H2O,
故答案為:Al2O3+2OH-=2AlO2-+H2O;
(3)W為S,對應的含氧酸分別為H2SO3、H2SO4,其中亞硫酸為弱酸,硫酸為強酸,比較兩種酸的酸性強弱,可分別:①用玻璃棒分別蘸取等濃度的兩種酸,滴到pH試紙上,觀察試紙紅色的深淺,顏色深的是硫酸,顏色淺的是亞硫酸;
②分別取等濃度的兩種酸溶液,測量導電性的強弱,導電性強的是硫酸,導電性弱的是亞硫酸;
③向亞硫酸鈉中滴加硫酸,檢驗是否生成SO2氣體,生成說明硫酸酸性強于亞硫酸,不生成說明硫酸酸性弱于亞硫酸.
故答案為:H2SO3;H2SO4;
①用玻璃棒分別蘸取等濃度的兩種酸,滴到pH試紙上,觀察試紙紅色的深淺,顏色深的是硫酸,顏色淺的是亞硫酸;
②分別取等濃度的兩種酸溶液,測量導電性的強弱,導電性強的是硫酸,導電性弱的是亞硫酸;
③向亞硫酸鈉中滴加硫酸,檢驗是否生成SO2氣體,生成說明硫酸酸性強于亞硫酸,不生成說明硫酸酸性弱于亞硫酸.
點評 本題考查結構性質與位置關系、元素周期律等,為高考常見題型和高頻考點,難度不大,關鍵是根據化合價結合原子序數進行推斷,首先審題中要抓住“短周期元素”幾個字.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| A. | 用NaOH溶液除去鋁箔表面的氧化膜 Al2O3+2OH-═2AlO2-+H2O | |
| B. | 向AlCl3溶液中加入過量氨水 Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| C. | 用胃舒平(復方氫氧化鋁)緩解胃酸(HCl)過多 OH-+H+═H2O | |
| D. | 向污水中投放明礬,生成能凝聚懸浮物的膠體Al3++3H2O?Al(OH)3 (膠體)+3H+ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 元素X位于第四周期,其基態原子的內層軌道全部排滿電子,且最外層電子數為1;元素Y基態原子的3p軌道上有5個電子;元素Z的原子最外層電子數是其內層電子數的3倍;元素W基態原子的核外電子共有16種運動狀態.
元素X位于第四周期,其基態原子的內層軌道全部排滿電子,且最外層電子數為1;元素Y基態原子的3p軌道上有5個電子;元素Z的原子最外層電子數是其內層電子數的3倍;元素W基態原子的核外電子共有16種運動狀態.查看答案和解析>>
科目:高中化學 來源: 題型:計算題
| 項目名稱 | 數據 | 參考值 |
| 尿素氮 | 3.95 | 2.00-6.10 m mol•L-1 |
| 葡萄糖 | 4.50 | 3.89-6.11 m mol•L-1 |
| 總膽固醇 | 3.80 | <5.20 m mol•L-1 |
| 甘油三酯 | 1.85↑ | <1.70 m mol•L-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 碳酸鈣與醋酸反應:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 鐵與氯化鐵溶液反應:Fe+Fe3+═2Fe2+ | |
| C. | 碳酸氫鈉溶液與氫氧化鈉溶液混合:HCO3-+OH-═H2O+CO2↑ | |
| D. | 將氯氣通入KBr溶液中:Cl2+2Br-═2Cl-+Br2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常溫下,測定0.1mol•L-1CH3COOH的pH值,若pH大于1,即可證明為弱電解質 | |
| B. | 等體積的0.1mol•L-1HCl和0.1mol•L-1醋酸溶液,分別與等量的相同顆粒度的Zn反應,觀察產生氣泡的速率,即可證明 | |
| C. | 等體積的0.1mol•L-1HCl和 0.1mol•L-1醋酸溶液,比較中和這兩種酸所需相同物質的量濃度的NaOH溶液的體積,即可證明 | |
| D. | 常溫下,測一定濃度的CH3COONa溶液的pH值,若pH大于7,即可證明 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常溫常壓下,48 g O2和 O3 含有的氧原子數均為 3NA | |
| B. | 將 0.1 mol 氯化鐵溶于沸水中,所得溶液含 Fe(OH)3 膠粒數為 0.1 NA | |
| C. | 1.7 g 氨氣所含有的電子數目為 10 NA | |
| D. | 22 g CO2與標準狀況下 11.2 L H2O 含有相同分子數 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com