
| A. | pH=3的醋酸溶液與pH=11的NaOH溶液等體積混合,所得溶液的pH<7 | |
| B. | 某物質的溶液中由水電離出的c(H+)=1×10-amol•L-1,若a>7,則該溶液的pH一定為14-a | |
| C. | 將0.2mol•L-1的某一元酸HA溶液和0.1mol•L-1 NaOH溶液等體積混合后,混合溶液的pH大于7,則反應后的混合溶液中:2c(OH-)=2c(H+)+c(HA)-c(A-) | |
| D. | pH=3的二元弱酸H2R溶液與pH=11的NaOH溶液混合后,混合溶液的pH=7,則反應后的混合溶液中:2c(R2-)+c(HR-)=c(Na+) |
分析 A.常溫下pH=3的醋酸濃度大于pH=11NaOH濃度,二者等體積混合,醋酸有剩余,溶液呈酸性;
B.某物質的溶液中由水電離出的c(H+)=1×10-amol•L-1,若a>7,說明水的電離受到抑制,則溶液中溶質為酸或堿;
C.將0.2mol•L-1的某一元酸HA溶液和0.1mol•L-1 NaOH溶液等體積混合后,溶液中溶質為等物質的量濃度的HA、NaA,混合溶液的pH大于7,說明HA電離程度小于水解程度A-,根據電荷守恒和物料守恒判斷;
D.pH=3的二元弱酸H2R溶液與pH=11的NaOH溶液混合后,混合溶液的pH=7,則c(H+)=c(OH-),結合電荷守恒判斷.
解答 解:A.常溫下pH=3的醋酸濃度大于pH=11NaOH濃度,二者等體積混合,醋酸有剩余,醋酸電離程度大于醋酸根離子水解程度,溶液呈酸性,所以溶液的pH<7,故A正確;
B.某物質的溶液中由水電離出的c(H+)=1×10-amol•L-1,若a>7,說明水的電離受到抑制,則溶液中溶質為酸或堿,所以溶液的pH可能是a或14-a,故B錯誤;
C.將0.2mol•L-1的某一元酸HA溶液和0.1mol•L-1 NaOH溶液等體積混合后,溶液中溶質為等物質的量濃度的HA、NaA,混合溶液的pH大于7,說明HA電離程度小于水解程度A-,根據電荷守恒得c(Na+)+c(H+)=c(OH-)+c(A-),根據物料守恒得2c(Na+)=c(A-)+c(HA),所以得2c(OH-)=2c(H+)+c(HA)-c(A-),故C正確;
D.pH=3的二元弱酸H2R溶液與pH=11的NaOH溶液混合后,混合溶液的pH=7,則c(H+)=c(OH-),結合電荷守恒得2c(R2-)+c(HR-)=c(Na+),故D正確;
故選B.
點評 本題考查離子濃度大小比較,為高頻考點,明確溶液中溶質及其性質、溶液酸堿性是解本題關鍵,注意電荷守恒、物料守恒的靈活運用,易錯選項是B,注意該溶液可能是酸也可能是堿,題目難度不大.


科目:高中化學 來源: 題型:選擇題
| A. | Fe3O4 | B. | Fe2O3 | C. | FeO | D. | FeO和Fe3O4 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 取12.0 g膽礬溶于480m L水中 | |
| B. | 取8.0 g CuSO4溶于480m L水 | |
| C. | 取12.5 g膽礬溶于水,再轉入500mL容量瓶中,加水至刻度 | |
| D. | 取12.5 g膽礬加熱除去結晶水,再放入500mL容量瓶中,加水至刻度 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 三者對應的氧化物均為酸性氧化物 | |
| B. | 三者的單質直接與氧氣反應都能生成兩種及以上氧化物 | |
| C. | 三者對應氫化物的水溶液可能呈中性、堿性、酸性 | |
| D. | C02、N02、S02都能與H20反應,其反應類型相同 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
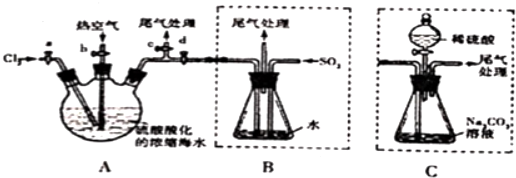
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 物質所含元素化合價升高的反應叫還原反應 | |
| B. | 能通過化合反應制得FeCl2和Fe(OH)3 | |
| C. | 某元素由化合態變為游離態,則它一定被還原 | |
| D. | 有單質參加的化學反應一定都是氧化還原反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 欲除去的少量雜質 | 方法 | 反應的離子方程式 |
| (1)Na2CO3溶液中的NaHCO3 | ||
| (2)NaCl溶液中的Na2CO3 | ||
| (3)NaHCO3溶液中的Na2CO3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1種 | B. | 2種 | C. | 3種 | D. | 4種 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
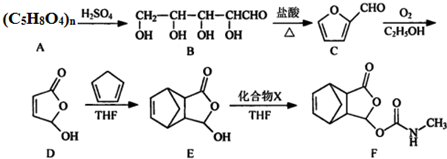
 .
.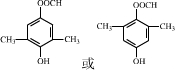 .
.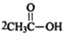 $\stackrel{P_{2}O_{3}}{→}$
$\stackrel{P_{2}O_{3}}{→}$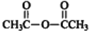 ,化合物
,化合物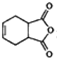 是合成抗病毒藥阿普洛韋的中間體,請設計合理方案以
是合成抗病毒藥阿普洛韋的中間體,請設計合理方案以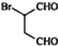 和
和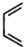 為原料合成該化合物(用合成路線流程圖表示:并注明反應條件).合成路線流程圖實力如下CH3CH2OH$→_{170℃}^{濃硫酸}$CH2═CH2$\stackrel{Br_{2}}{→}$
為原料合成該化合物(用合成路線流程圖表示:并注明反應條件).合成路線流程圖實力如下CH3CH2OH$→_{170℃}^{濃硫酸}$CH2═CH2$\stackrel{Br_{2}}{→}$
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com