
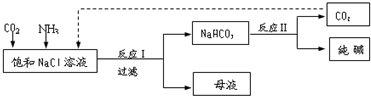
分析 (1)根據制純堿的原理可知反應Ⅰ的化學方程式;
(2)①根據流程可知,母液中含有氯化銨,加入石灰乳后可以生成氨氣,;
②根據氨水電離成銨根和氫氧根離子,增大銨根的濃度有利于氯化銨的析出來分析,溶液堿性增強,使碳酸氫鈉轉換為溶解度較大的碳酸鈉,加入細小的食鹽顆粒,增大氯離子的濃度,可得到NH4Cl晶體;
(3)溫度越低,NaHCO3的溶解度越小,降低NaHCO3的溶解度,使之更易析出,然后過濾、洗滌、灼燒;
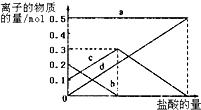
(4)混合物是碳酸鈉和碳酸氫鈉,滴入鹽酸發(fā)生反應CO32-+H+=HCO3-;HCO3-+H+=CO2↑+H2O;依據圖象分析碳酸根離子減小,碳酸氫根離子增多.
解答 解:(1)根據制純堿的原理可知反應Ⅰ的化學方程式為:NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl,故答案為:NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl;
(2)①根據流程可知,母液中含有氯化銨,加入石灰乳后可以生成氨氣,方程式為2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O,
故答案為:2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O;NH3;
②根據氨水電離成銨根和氫氧根離子,增大銨根的濃度有利于氯化銨的析出來分析,溶液堿性增強,使碳酸氫鈉轉換為溶解度較大的碳酸鈉,加入細小的食鹽顆粒,增大氯離子的濃度,可得到NH4Cl晶體,故答案為:通入NH3,加入細小的食鹽顆粒;
(3)NaHCO3的溶解度隨著溫度的降低而減小,故用冷水可以使溶液冷卻,降低NaHCO3的溶解度,使之更易析出,然后過濾、洗滌、灼燒,
故答案為:冷卻,使NaHCO3晶體析出;過濾;
(4)若在(3)中灼燒的時間較短,NaHCO3將分解不完全,該小組對一份加熱了t1min的NaHCO3樣品的組成進行了研究.取加熱了t1min的NaHCO3樣品29.6g 完全溶于水制成溶液,然后向此溶液中緩慢地滴加稀鹽酸,并不斷攪拌.隨著鹽酸的加入,發(fā)生反應 CO32-+H+=HCO3-; HCO3-+H+=CO2↑+H2O;溶液中有關離子的物質的量的變化為:碳酸根離子減小,碳酸氫根離子濃度增大,當碳酸根離子全部轉化為碳酸氫根離子,再滴入鹽酸和碳酸氫根離子反應生成二氧化碳,碳酸氫根離子減小,在此過程中,Na+不參與反應,物質的量一直不變,故a曲線表示的是Na+濃度的變化;所以c曲線表示的是碳酸氫根離子物質的量變化;碳酸根離子物質的量0.2mol;碳酸氫根離子物質的量為0.1mol,故答案為:HCO3-;0.1;0.2.
點評 本題考查了工業(yè)制純堿的原理分析,生產過程中的物質變化,混合物成分的分析判斷和計算應用,實驗過程分析,除雜操作,尾氣吸收,圖象定量分析判斷,題目難度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:選擇題
| 實驗操作 | 實現(xiàn)現(xiàn)象 | 結論 | |
| A | 用飽和碳酸鈉溶液浸泡鍋爐沉積物后,過濾,洗滌,在所得沉淀物中再加入稀鹽酸 | 有氣泡產生 | 可除去鍋爐沉淀物中的CaSO4 |
| B | 某充滿NO2的密閉容器中,待反應平衡后,保持溫度不變,擴大容器體積 | 氣體顏色變淺 | 平衡2NO2(g)?N2O4(g)正向移動 |
| C | 向品紅溶液中通入某氣體 | 溶液褪色 | 該氣體是SO2 |
| D | 用潔凈鉑絲蘸取溶液置于酒精燈火焰上灼燒 | 火焰呈黃色 | 溶液中含Na+,無K+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
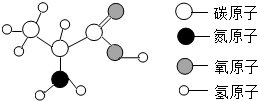 蛋白質是由多種氨基酸構成的極為復雜的化合物,相對分子質量從幾萬到幾百萬.如圖為丙氨酸分子結構模型,下列關于丙氨酸的說法正確的是( )
蛋白質是由多種氨基酸構成的極為復雜的化合物,相對分子質量從幾萬到幾百萬.如圖為丙氨酸分子結構模型,下列關于丙氨酸的說法正確的是( )| A. | 它是由四種元素組成的有機高分子化合物 | |
| B. | 每個丙氨酸分子中含有13個原子核 | |
| C. | 丙氨酸分子中含有3個碳原子 | |
| D. | 丙氨酸分子中氮、氧元素的質量比為1:2 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
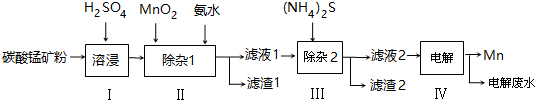
| 物質 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
| Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
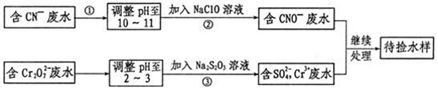
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯(lián)網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com