
分析 配制含有NH4+、Cl-、K+、SO42-的植物培養液450mL,實驗室中沒有450mL的容量瓶,實際上配制的是500mL該溶液,
(1)要求該培養液中c(Cl-)=c(K+)=c(SO42-)=0.4mol•L-1,依據電荷守恒計算溶液中銨根離子濃度;
(2)依據m=cVM及質量守恒定律計算選用溶質的質量;
(3)已知培養液中c(Cl-)=c(K+)=c(SO42-)=0.4mol•L-1,根據質量守恒計算出(NH4)2SO4、NH4Cl和K2SO4的物質的量,再計算出三者的物質的量之比.
解答 解:配制含有NH4+、Cl-、K+、SO42-的植物培養液450mL,實驗室中沒有450mL的容量瓶,實際上配制的是500mL該溶液,
(1)且要求該培養液中c(Cl-)=c(K+)=c(SO42-)=0.4mol•L-1,依據溶液中電荷守恒規律可知:
c(Cl-)+2c(SO42-)=c(K+)+c(NH4+),0.4mol/L+2×0.4mol/L=0.4mol/L+c(NH4+),得c(NH4+)=0.8mol/L;
故答案為:0.8mol/L;
(2)要求該培養液中c(Cl-)=c(K+)=0.4mol•L-1,c(NH4+)=0.8mol/L,則需要氯化鉀的物質的量濃度為0.4mol/L,需要氯化鉀固體質量為:m=0.4mol/L×0.5L×74.5g/mol=14.9g;
要使c(SO42-)=0.4mol•L-1,c(NH4+)=0.8mol/L,則需要硫酸銨的物質的量濃度為0.4mol/L,需要硫酸銨固體質量為:m=0.4mol/L×0.5L×132g/mol=26.4g,
故答案為:14.9;26.4;
(3)配制含有NH4+、Cl-、K+、SO42-的植物培養液500mL,且溶液中c(Cl-)=c(K+)=c(SO42-)=0.4mol•L-1,根據(1)可知c(NH4+)=0.8mol/L,根據鉀離子守恒需要K2SO4的物質的量為:n(K2SO4)=$\frac{1}{2}$×0.4mol/L×0.5L=0.1mol,根據硫酸根離子守恒可知需要(NH4)2SO4的物質的量為:n((NH4)2SO4)=0.4mol/L×0.5L-0.1mol=0.1mol,根據銨根離子守恒可知需要NH4Cl的物質的量為:n(NH4Cl)=0.8mol/L×0.5L-0.1mol×2=0.2mol,
所以則(NH4)2SO4、NH4Cl、K2SO4三種物質的物質的量之比=0.1mol:0.2mol:0.1mol=1:2:1,
故答案為:1:2:1.
點評 本題考查了物質的量濃度的計算,題目難度中等,正確判斷配制溶液的體積為解答關鍵,注意掌握守恒思想在化學計算中的應用方法,試題培養了學生的分析、理解能力及化學計算能力.


科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常溫下,1L0.1mol/L的NH4NO3溶液中氮原子數為0.2NA | |
| B. | 1mol羥基中電子數為10NA | |
| C. | 在含4mol Si-O鍵的二氧化硅中,氧原子數為4NA | |
| D. | 常溫常壓下,22.4L乙烯中C-H鍵數為4NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
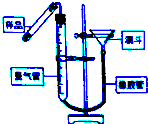 過氧化鈣(CaO2•8H2O)是一種在水產養殖中廣泛使用的供氧劑.
過氧化鈣(CaO2•8H2O)是一種在水產養殖中廣泛使用的供氧劑.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 該反應中氧化劑只有FeCl3 | |
| B. | NaBH4的電子式為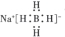 | |
| C. | NaBH4與稀硫酸不發生反應 | |
| D. | 該反應中每生成1 mol Fe,轉移的電子數為3mol |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
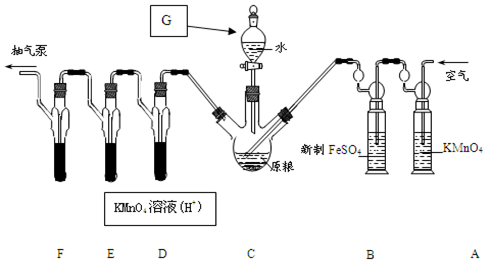
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
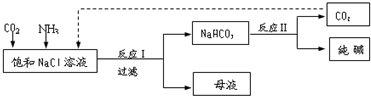
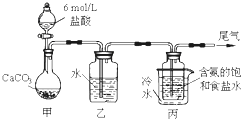
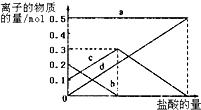
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
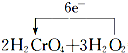 =2Cr(OH)3↓+3O2↑+2H2O.
=2Cr(OH)3↓+3O2↑+2H2O.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com