
| 物質 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
| Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
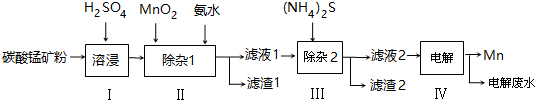
分析 向碳酸錳礦(主要成分為MnCO3,還含有鐵、鎳、鈷等碳酸鹽雜質)中加入硫酸,可以發生反應生成硫酸鹽,向其中就如具有氧化性的二氧化錳,可以將亞鐵離子氧化為鐵離子,調節pH可以將氫氧化鐵沉淀下來,向濾液中加入硫化銨,可以將鎳離子、鈷離子形成硫化物沉淀下來,最后對得到的含有錳離子的鹽電解,可以得到金屬錳,以此解答該題.
解答 解:(1)攪拌固體和液體的混合物,升高溫度、增大濃度等,可加快反應速率,所以為了提高浸取率可采取的措施有加熱或攪拌或增大硫酸濃度等,
故答案為:升高溫度、適當增大硫酸濃度、減小礦粉顆粒直徑;
(2)步驟Ⅱ中,MnO2在酸性條件下可將Fe2+離子氧化為Fe3+,反應的離子方程式MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O,加入氨水調節pH為5.0~6.0,發生Fe3++3NH3﹒H2O=Fe(OH)3↓+3NH4+,可得到沉淀Fe(OH)3,
故答案為:Fe(OH)3;2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O;Fe3++3NH3﹒H2O=Fe(OH)3↓+3NH4+;
(3)向濾液中滴入適量的(NH4)2S溶液,目的是除去Co2+、Ni2+,若(NH4)2S的濃度過大,產生MnS沉淀,造成產品損失,
故答案為:若(NH4)2S的濃度過大,產生MnS沉淀,造成產品損失;
(4)CoS、NiS的Ksp分別為5.0×10-22、1.0×10-22,加入足量(NH4)2S溶液后,生成CoS、NiS沉淀,溶液中c(Co2+):c(Ni2+)=5.0×10-22:1.0×10-22=5:1,
故答案為:5:1;
(5)濾渣1為為Fe(OH)3,質量為c kg,則n(Fe3+)=n(Fe(OH)3)=$\frac{1000c}{107}$mol,由2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O可知n(MnO2)=$\frac{1}{2}$×$\frac{1000c}{107}$mol,
將質量為a㎏的碳酸錳礦經上述流程處理后得到單質Mn b kg,n(Mn)=$\frac{1000b}{55}$mol,
可知n(MnCO3)=$\frac{1000b}{55}$mol-$\frac{1}{2}$×$\frac{1000c}{107}$mol,
m(MnCO3)=($\frac{1000b}{55}$mol-$\frac{1}{2}$×$\frac{1000c}{107}$mol)×115g/mol,
則原碳酸錳礦中MnCO3的質量分數為$\frac{(b-\frac{c}{107}×\frac{1}{2}×55)×\frac{115}{55}}{a}$×100%,
故答案為:$\frac{(b-\frac{c}{107}×\frac{1}{2}×55)×\frac{115}{55}}{a}$×100%.
點評 本題考查了制備方案的設計,為高考常見題型,題目難度中等,根據制備流程明確制備原理為解答關鍵,試題培養了學生的分析、理解能力及化學實驗能力.


 備戰中考寒假系列答案
備戰中考寒假系列答案科目:高中化學 來源: 題型:選擇題
| A. | 0.5molO3與11.2LO2所含的分子數一定相等 | |
| B. | 25℃與60℃時,水的pH相等 | |
| C. | 中和等體積、等物質的量的濃度的鹽酸和醋酸所消耗的n(NaOH)相等 | |
| D. | 2SO2(g)+O2(g)=2SO3(g)和4SO2(g)+2O2(g)=4SO3(g)的△H相等 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 若混合氣體的密度不再改變時,該反應不一定達到平衡狀態 | |
| B. | 2min后,加壓會使正反應速率增大,逆反應速率減小,平衡正向移動 | |
| C. | 反應過程中A和B的轉化率之比為3:1 | |
| D. | 該條件下此反應的化學平衡常數的數值約為0.91 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
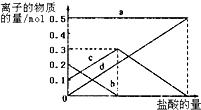
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
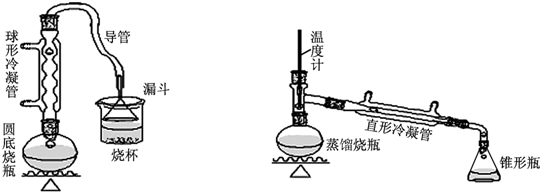
| 物質 | 熔點/℃ | 沸點/℃ |
| 1-丁醇 | -89.5 | 117.3 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.3 | -6.5 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
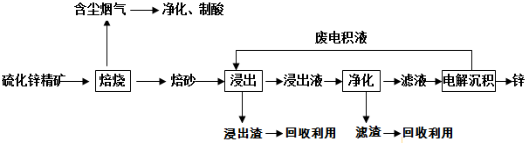
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
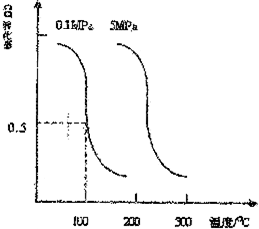 研究和開發CO2 和CO的創新利用是環境保護和資源利用的雙贏的課題.
研究和開發CO2 和CO的創新利用是環境保護和資源利用的雙贏的課題.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com