
分析 (1)根據氮原子的軌道表示式來解答;
(2)某元素原子與N3-含有相同的電子數,則該元素的電子數為22,先寫出基態原子的電子排布式,然后寫出價電子排布式;
(3)氫鍵的形成原因是孤電子對與原子核之間的引力,這就要求另一個條件為原子核要小,所以一般為O,N,F原子,像NH3有一對孤電子對,N2H4有兩對孤電子對,所以NH3、N2H4等能形成氫鍵,而NH4+、N2H62+ 中孤電子對都與H+離子共用,從而也就沒有了孤電子對,沒有孤電子對不能形成配位體;
(4)分子間氫鍵使物質的沸點升高;
(5)①根據分子中δ鍵數目與孤電子對數目判斷;
②反應中有4mol N-H鍵斷裂,生成1.5molN2,根據結構式N≡N判斷;
③N2H6SO4晶體類型與硫酸銨相同,應含有配位鍵、離子鍵和共價鍵.
解答 解:(1)氮原子能量最低排布是: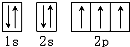 ,有3個運動狀態不同的未成對電子,故答案為:3;
,有3個運動狀態不同的未成對電子,故答案為:3;
(2)某元素原子的電子數為22,該元素基態原子的電子排布式為:1s22s22p63s23p63d24s2,價電子排布式為:3d24s2;
故答案為:3d24s2;
(3)氫鍵的形成原因是孤電子對與原子核之間的引力,這就要求另一個條件為原子核要小,所以一般為O,N,F原子,像NH3有一對孤電子對,N2H4有兩對孤電子對.所以NH3,N2H4等能形成氫鍵,而NH4+,N2H62+ 中孤電子對都與H+離子共用,從而也就沒有了孤電子對;不能作為配位體的有NH4+,N2H62+,
故答案為:NH3,N2H4;NH4+,N2H62+.
(4)HN3分子間存在氫鍵,所以HN3在常溫下是一種液體,但沸點較高;
故答案為:HN3分子間存在氫鍵;
(5)①由于N2H4分子中N原子形成3個δ鍵,且有1個孤電子對,N原子sp3雜化;
故答案為:sp3;
②N2O4+2N2H4═3N2+4H2O,若該反應中有4mol N-H鍵斷裂,即有1mol N2H4參加反應,生成1.5mol N2,形成π鍵的物質的量為2×1.5mol=3mol;
故答案為:3;
(6)③肼與硫酸反應的離子方程式為N2H4+2H+═N2H62+,N2H6SO4晶體類型與硫酸銨相同,N2H62+中的化學鍵是共價鍵與配位鍵,N2H62+與SO42-之間是離子鍵,不存在范德華力;
故答案為:d.
點評 本題考查考查原子結構與性質,涉及核外電子排布、雜化類型、配位鍵等知識,綜合考查學生的分析能力和基本概念的綜合運用能力,同時把氫鍵的來龍去脈和特點進行了徹底考查,是一道難得的好題,題目難度中等.


 黃岡天天練口算題卡系列答案
黃岡天天練口算題卡系列答案科目:高中化學 來源: 題型:選擇題
| A. | 硝酸銀溶液中加入氯化鈉:Ag++Cl-═AgCl↓ | |
| B. | 稀 H2SO4與鐵粉反應:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 氫氧化鋇溶液與稀 H2SO4 反應:Ba2++SO42-═BaSO4↓ | |
| D. | 碳酸鈣與鹽酸反應:CO32-+2H+═H2O+CO2↑ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在海水與河水交界處,已形成沙洲 | |
| B. | 清晨林間透過縷縷陽光 | |
| C. | 三氯化鐵溶液中加入NaOH出現紅褐色沉淀 | |
| D. | 向煮熟的豆漿里加入石膏或鹵水以生產豆腐 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①→②→③→④→① | B. | ②→①→④→③→① | C. | ②→④→①→③→① | D. | ③→④→①→②→① |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 陽離子 | Fe3+ | Fe2+ | Cu2+ |
| 開始沉淀時的pH | 1.9 | 7.0 | 4.7 |
| 沉淀完全時的pH | 3.2 | 9.0 | 6.7 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com