

分析 (1)①過氧化鈉和水反應生成氫氧化鈉是堿,堿遇酚酞變紅;紅色褪去的可能原因是過氧化鈉和水反應生成的過氧化氫具有氧化性;
②過氧化氫在二氧化錳做催化劑分解生成水和氧氣;
(2)①分析裝置圖和實驗步驟可知,盛鹽酸的儀器為長頸漏斗;B裝置是除去氫氣中的水蒸氣;
②氫氣是可燃性氣體混有空氣乙點燃發(fā)生爆炸;
③D裝置是防止空氣中的二氧化碳和水蒸氣進入C影響實驗驗證;
④實驗現(xiàn)象分析可知過氧化鈉變?yōu)榘咨腆w,硫酸銅不變藍色證明無水生成,證明氫氣和過氧化鈉反應生成氫氧化鈉.
解答 解:(1)①過氧化鈉和水反應生成氫氧化鈉是堿,堿遇酚酞變紅;紅色褪去的可能原因是過氧化鈉和水反應生成的過氧化氫具有氧化性,能氧化有色物質(zhì),
故答案為:過氧化鈉和水反應生成堿氫氧化鈉;反應生成的H2O2具有漂白作用;
②過氧化氫在二氧化錳做催化劑分解生成水和氧氣,反應的化學方程式為:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,
故答案為:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
(2)①分析裝置圖和實驗步驟可知,盛鹽酸的儀器為長頸漏斗;B裝置是吸收氫氣中的雜質(zhì)氣體,除去氫氣中的水蒸氣等,
故答案為:長頸漏斗;吸收氫氣中的雜質(zhì)氣體;
②氫氣是可燃性氣體混有空氣易點燃發(fā)生爆炸,驗純防止空氣與氫氣混合加熱爆炸,
故答案為:防止空氣與氫氣混合加熱爆炸;
③D裝置是防止空氣中的二氧化碳和水蒸氣進入C影響實驗驗證,
故答案為:防止空氣中的二氧化碳和水蒸氣進入C裝置和過氧化鈉反應影響實驗驗證;
④實驗現(xiàn)象分析可知過氧化鈉變?yōu)榘咨腆w,硫酸銅不變藍色證明無水生成,證明氫氣和過氧化鈉反應生成氫氧化鈉,反應的化學方程式為Na2O2+H2$\frac{\underline{\;\;△\;\;}}{\;}$2NaOH,
故答案為:氫氣和過氧化鈉反應生成氫氧化鈉,Na2O2+H2$\frac{\underline{\;\;△\;\;}}{\;}$2NaOH.
點評 本題考查了物質(zhì)性質(zhì)的實驗驗證和分析判斷,實驗步驟的設計方法和注意問題,掌握物質(zhì)性質(zhì)和實驗基本操作是解題關鍵,題目難度中等.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:選擇題
| A. | H2SO4、K、HCl | B. | Cl2、Al、H2 | C. | NO2、Na、Br2 | D. | O2、SO2、H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 混合溶液中由水電離出的c(OH-)═10-8 mol•L-1 | |
| B. | c(Na+)═c(X-)+c(HX)=0.1mol•L-1 | |
| C. | c(Na+)-c(X-)═9.9×10-7mol•L-1 | |
| D. | c(OH-)-c(HX)═c(H+)=1×10-8mol•L-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 7.8gNa2S和Na2O2的固體混合物中含有的陰離子數(shù)目為0.1NA | |
| B. | 用銅做電極電解CuSO4溶液的反應方程式:2Cu2++2H2O$\frac{\underline{\;電解\;}}{\;}$2Cu+O2↑+4H+ | |
| C. | 等質(zhì)量的N2和CO所含原子數(shù)均為2NA | |
| D. | pH等于2的醋酸溶液中加入0.01mol/L的鹽酸,溶液pH會變小 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ②⑤ | B. | ②④⑥ | C. | ②④ | D. | ③⑤⑥ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
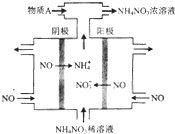 氮可形成多種氧化物,如NO、NO2、N2O4等.
氮可形成多種氧化物,如NO、NO2、N2O4等.| 時間/s | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Mg2+、Cl-、Na+、NO3- | B. | K+、Na+、NO3-、HCO3- | ||
| C. | Na+、K+、Cl-、NO3- | D. | Na+、Cl-、AlO2-、SO42- |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
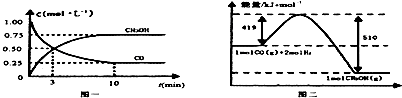
| 容器 | 反應物投入的量 | 反應物的 轉化率 | CH3OH的濃度 | 能量變化 (Q1、Q2、Q3均大于0) |
| 甲 | 1mol CO和2mol H2 | α1 | c1 | 放出Q1kJ熱量 |
| 乙 | 1mol CH3OH | α2 | c2 | 吸收Q2kJ熱量 |
| 丙 | 2mol CO和4mol H2 | α3 | c3 | 放出Q3kJ熱量 |
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com