
分析 (1)弱酸在溶液中部分電離,導電能力較弱;
(2)硫酸為二元酸,在溶液中完全電離;加水稀釋,氫離子濃度減小;
(3)電離度=$\frac{已電離的醋酸}{醋酸的總濃度}$×100%,根據Ka=$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$計算.
解答 解:濃度為0.1mol•L-1的鹽酸中c(H+)=0.1mol/L,硫酸中c(H+)=0.2mol/L,醋酸中c(H+)<0.1mol/L,
(1)醋酸是弱酸在溶液中部分電離,其溶液中離子濃度較小,導電能力較弱;
故答案為:醋酸;醋酸;
(2)硫酸為二元酸,在溶液中完全電離,硫酸中c(H+)=0.2mol/L,所以三種溶液中氫離子濃度最大的是硫酸;加水稀釋100倍,強酸中氫離子濃度變為原來的$\frac{1}{100}$,弱酸中氫離子要大于原來氫離子濃度的$\frac{1}{100}$,所以加水稀釋100倍,氫離子濃度等于0.002mol•L-1的是硫酸;
故答案為:硫酸;硫酸;
(3)醋酸溶液中氫離子濃度為0.004mol•L-1,則醋酸的電離度=$\frac{已電離的醋酸}{醋酸的總濃度}$×100%=$\frac{0.004}{0.1}$×100%=4%,
醋酸的電離常數為Ka=$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$=$\frac{0.004×0.004}{0.1-0.004}$=1.6×10-5;
故答案為:4%;1.6×10-5.
點評 本題考查了弱電解質的電離、電離平衡常數的計算,題目難度不大,側重于考查學生的分析能力和計算能力,注意把握電離常數的計算方法.


科目:高中化學 來源: 題型:解答題
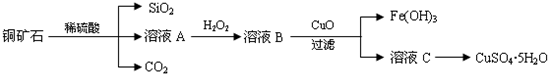
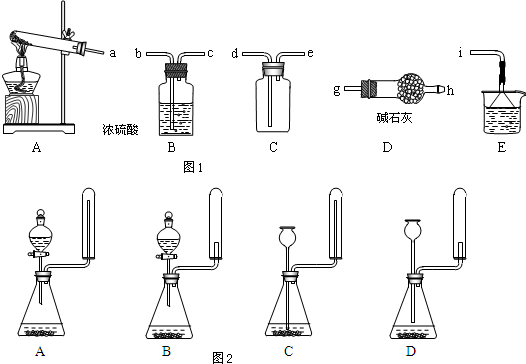
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.2 mol•L-1氨水中,c(OH-)與c(NH4+)相等 | |
| B. | 0.1 mol/L的Na2S溶液中,c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| C. | pH=3的一元酸和pH=11的一元堿等體積混和后的溶液中一定是c(OH-)=c(H+) | |
| D. | 10mL0.02mol•L-1HCl溶液與10mL0.02mol•L-1Ba(OH)2溶液充分混合,若混合后溶液的體積為20 mL,則溶液的pH=12 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 254gI2(g)中通入2gH2(g),反應放熱9.48kJ | |
| B. | 當反應②吸收52.96kJ熱量時轉移2mole- | |
| C. | 反應②的反應物總能量比反應①的反應物總能量低 | |
| D. | 1mol固態碘與1mol氣態碘多了17.00kJ能量 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 實驗目的 | 主要儀器 | 試劑 | |
| A | 分離Br2和CCl4混合物 | 分液漏斗、燒杯 | Br2和CCl4混合物、蒸餾水 |
| B | 鑒別葡萄糖和蔗糖 | 試管、燒杯、酒精燈 | 葡萄糖溶液、蔗糖溶液、銀氨溶液 |
| C | 實驗室制取H2 | 試管、帶導管的橡皮塞 | 鋅粒、稀HNO3 |
| D | 測定NaOH溶液濃度 | 滴定管、錐形瓶、燒杯 | NaOH溶液、0.1000mol•L-1鹽酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 弱電解質需要通電才能發生電離 | |
| B. | 醋酸達到電離平衡時,不存在:CH3COO-+H+?CH3COOH | |
| C. | H2SO4是共價化合物,所以它是弱電解質 | |
| D. | 電離平衡右移,電解質分子的濃度不一定減小 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1.00 mol NaCl 中含有 6.02×1023個分子 | |
| B. | 1.00 mol NaCl 中,所有Na+的電子總數為 10×6.02×1023 | |
| C. | 欲配制 1.00 L 1.00 mol/L 的NaCl溶液,可將 58.5gNaCl溶于 1.00L 水中 | |
| D. | 電解 58.5g 熔融的 NaCl,能產生22.4L氯氣(標準狀況)、23.0g 金屬鈉 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 濃硫酸和NaOH溶液反應,生成 lmol水時放熱57.3kJ | |
| B. | 含lmolH2SO4的稀硫酸與足量稀NaOH溶液中和后,放熱為57 kJ | |
| C. | 1L0.lmol/L CH3COOH與1L0.lmol/L NaOH溶液反應后放熱為5.73kJ | |
| D. | 1L0.lmol/L HNO3與 1L0.lmol/L NaOH溶液反應后放熱為 5.73kJ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com