
| A. | 0.2 mol•L-1氨水中,c(OH-)與c(NH4+)相等 | |
| B. | 0.1 mol/L的Na2S溶液中,c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| C. | pH=3的一元酸和pH=11的一元堿等體積混和后的溶液中一定是c(OH-)=c(H+) | |
| D. | 10mL0.02mol•L-1HCl溶液與10mL0.02mol•L-1Ba(OH)2溶液充分混合,若混合后溶液的體積為20 mL,則溶液的pH=12 |
分析 A.氨水中存在電荷守恒;
B.根據質子守恒分析;
C.討論酸堿的強弱及反應情況;
D.計算混合后的c(OH-),再計算溶液的PH.
解答 解:A.氨水中主要成分是NH3•H2O,NH3•H2O是一元弱堿,電離產生NH4+和OH-,H2O也電離出OH-,溶液中的電荷守恒為c(NH4+)+c(H+)=c(OH-),所以c(NH4+)<c(OH-),故A錯誤;
B.由質子守恒知,c(OH-)=c(H+)+c(HS-)+2c(H2S),故B錯誤;
C.若是強酸與強堿混合有c(OH-)=c(H+),若是強酸與弱堿,有c(H+)<c(OH-),若是弱酸與強堿,有c(H+)>c(OH-),故C錯誤.
D.10ml0.02mol/L的HCl溶液與10ml0.02mol/L的Ba(OH)2溶液充分混合后,若混合后溶液體積為20ml,
反應后的溶液中c(OH-)=$\frac{0.04mol/L×0.01L-0.02mol/L×0.01L}{0.02L}$=0.01mol/L,c(H+)=$\frac{1×1{0}^{-14}}{0.01}$mol/L=1×10-12mol/L,PH=-lg1×10-12=12,故D正確.
故選D.
點評 本題考查溶液離子濃度大小計較,題目難度中等,做題時注意從電荷守恒、物料守恒、質子守恒的角度著手分析,本題注意溶液PH的計算方法.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| A. | 鋼鐵因含雜質而容易發生電化學腐蝕,所以合金都不耐腐蝕 | |
| B. | 原電池反應是導致金屬腐蝕的主要原因,故不能用原電池原理來減緩金屬的腐蝕 | |
| C. | 鋼鐵電化學腐蝕的兩種類型主要區別在于水膜的酸性不同,引起的正極反應不同 | |
| D. | 無論哪種類型的腐蝕,其實質都是金屬被還原 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
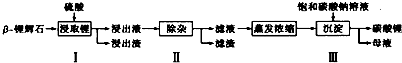
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 25℃時,三種酸的電離常數為:
25℃時,三種酸的電離常數為:| 化學式 | CH3COOH | H2CO3 | HClO |
| 電離平衡常數K | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 向稀氨水中滴加稀鹽酸至恰好中和:[NH4+]═[Cl-] | |
| B. | 硫酸鈉溶液中:[Na+]+[H+]═[OH-]+2[SO42-] | |
| C. | 0.1mol?L-1Na2S溶液中:[S2-]+[HS-]+[H2S]═[Na+] | |
| D. | 向CH3COONa溶液中加適量蒸餾水:[CH3COO-]與[OH-]都減小,[OH-]/[CH3COO-]也減小 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 水的電離常數先增大后減小 | |
| B. | 當氨水和甲酸溶液體積相等時,c(HCOO-)=c(NH4+) | |
| C. | c(NH3•H2O)與c(NH4+)之和始終保持不變 | |
| D. | $\frac{c(N{{H}_{4}}^{+})c(HCO{O}^{-})}{c(N{H}_{3}•{H}_{2}O)c(HCOOH)}$始終保持不變 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 使用微波手術刀進行外科手術,可使開刀處的血液迅速凝固而減少失血 | |
| B. | 在飽和氯化鐵溶液中逐滴加入NaOH溶液,產生紅褐色沉淀 | |
| C. | 清晨的陽光穿過茂密的林木枝葉所產生的美麗景象(光線) | |
| D. | 用石膏或鹽鹵點制豆腐 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com