
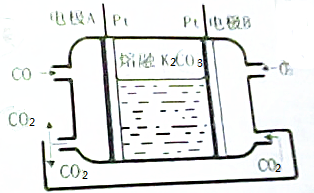
分析 (1)負極發生氧化反應,電極反應式為:CO-2e-+CO32-=2CO2;
(2)B極電極反應式為:O2+4e-+2CO2=2CO32-;而A極的電極反應式為:CO-2e-+CO32-=2CO2;
解答 解:(1)負極發生氧化反應,電極反應式為:CO-2e-+CO32-=2CO2,故答案為:CO-2e-+CO32-=2CO2;
(2)根據負極2CO+2CO32--4e-=4CO2,而正極反應為O2+4e-+2CO2═2CO32-,所以在轉移4mol電子相同的情況下負極產生4mol的二氧化碳,而正極消耗2mol的二氧化碳,所以利用率為50%,故答案為:50%.
點評 本題考查電化學的相關知識,學生要掌握原電池的反應原理,以及在電子轉移相等的情況下計算物質的轉化率,比較容易.


 培優好卷單元加期末卷系列答案
培優好卷單元加期末卷系列答案科目:高中化學 來源: 題型:多選題
| A. | 鋼制品應接電源的正極 | |
| B. | 電鍍時鋁作陽極,陽極反應式為Al-3e-+7AlCl4-=4Al2Cl7- | |
| C. | 電解液中H+移向陰極,OH-移向陽極 | |
| D. | 每生成1mol鋁,電解液中轉移3mol電子 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

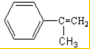
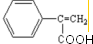
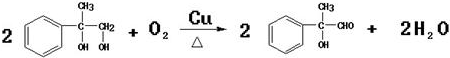 ;反應⑦n
;反應⑦n $\stackrel{一定條件下}{→}$
$\stackrel{一定條件下}{→}$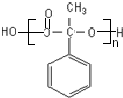 +(n-1)H2O
+(n-1)H2O查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 元素周期表的形式多種多樣,下圖是扇形元素周期表的一部分(1~36號元素),對比中學常見元素周期表思考扇形元素周期表的填充規律,下列說法正確的是( )
元素周期表的形式多種多樣,下圖是扇形元素周期表的一部分(1~36號元素),對比中學常見元素周期表思考扇形元素周期表的填充規律,下列說法正確的是( )| A. | ②、⑧、⑨對應的簡單離子半徑依次增大 | |
| B. | ⑥的氯化物的熔點比⑦的氯化物熔點高 | |
| C. | 元素⑩處于常見周期表第四周期第VIIIB族 | |
| D. | ①分別與③、④、⑤均可形成既含極性鍵又含非極性鍵的非極性分子 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Cl2、SO2、NH3的水溶液雖都能夠導電,但它們均屬于非電解質 | |
| B. | 在濃硝酸中加入等體積濃硫酸后,立即加入鋁片,鋁片發生鈍化 | |
| C. | 任何可逆反應,其平衡常數越大,反應速率、反應物的轉化率就越大 | |
| D. | 電解飽和食鹽水的過程中,水的電離平衡正向移動 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 氣體的自動化檢測中常常應用原電池原理的傳感器.如圖為電池的工作示意圖:氣體擴散進入傳感器,在敏感電極上發生反應,傳感器就會接收到電信號.下表列出了待測氣體及敏感電極上部分反應產物.則下列說法中正確的是( )
氣體的自動化檢測中常常應用原電池原理的傳感器.如圖為電池的工作示意圖:氣體擴散進入傳感器,在敏感電極上發生反應,傳感器就會接收到電信號.下表列出了待測氣體及敏感電極上部分反應產物.則下列說法中正確的是( )| 待測氣體 | 部分電極反應產物 |
| NO2 | NO |
| Cl2 | HCl |
| CO | CO2 |
| H2S | H2SO4 |
| A. | 上述氣體檢測時,敏感電極均作電池正極 | |
| B. | 檢測Cl2時,敏感電極上發生還原反應 | |
| C. | 檢測H2S時,對電極充入空氣,對電極上的電極反應式為O2+2H2O+4e-═4OH- | |
| D. | 檢測分別含H2S和CO體積分數相同的兩份空氣樣本時,傳感器上產生電流大小相同 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題


 .
.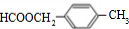 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 實驗室常用點滴板來完成部分實驗,這樣可以節約藥品的用量,又便于觀察實驗現象.圖中所示的實驗描述的現象正確的是( )
實驗室常用點滴板來完成部分實驗,這樣可以節約藥品的用量,又便于觀察實驗現象.圖中所示的實驗描述的現象正確的是( )| A. | ①②③⑤ | B. | ①②⑥ | C. | ③⑤⑥ | D. | ②③⑤ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com