
分析 (1)根據蓋斯定律進行計算,由(②+①)÷2-③得出正確結論;
(2)根據v=$\frac{△c}{△t}$進行計算;
(3)根據甲醇的轉化率計算平衡時各物質的濃度,再根據平衡常數等于生成物的濃度冪之積除以反應物的濃度冪之積計算平衡常數;
平衡狀態時,正逆反應速率相等;
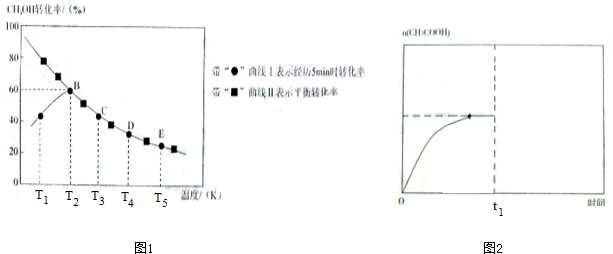
(4)由曲線Ⅰ可知:T1-T2階段,5min時,反應未達平衡狀態,故升高溫度,化學反應速率加快,甲醇轉化率隨溫度的升高而增大;
(5)根據濃度商與平衡常數的大小關系,判斷反應進行的方向;
(6)當時間到達t1時,將該反應體系溫度迅速上升到T3,并維持該溫度,溫度升高,平衡逆向移動,乙酸的物質的量減小,一段時間后達到平衡狀態,乙酸的物質的量保持不變.
解答 解:(1)①2CO(g)+O2(g)=2CO2(g)△H=-566kJ•mol-1
②2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l)△H=-1529kJ•mol-1
③CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H=-874kJ•mol-1
由(②+①)÷2-③得,CH3OH(g)+CO(g)?CH3COOH(l)△H=$\frac{(-566kJ•mo{l}^{-1})+(-1529kJ•mo{l}^{-1})}{2}$-(-874kJ•mol-1)=-173.5kJ•mol-1,
故答案為:-173.5;
(2)由曲線Ⅰ可知:T2溫度下,5min時測得的甲醇的轉化率為60%,故轉化的甲醇的物質的量為0.20mol×60%=0.12mol,則生成乙酸的物質的量為0.12mol,故在溫度為T3時,從反應開始至5min時,用單位時間內物質的量變化表示的乙酸的平均反應速率為$\frac{0.12mol}{5min}$=0.024mol•min-1,
故答案為:0.024;
(3)由解答(2)可知:在溫度為T2時,轉化的甲醇的物質的量為0.12mol,則轉化的CO的物質的量為0.12mol,故平衡時甲醇的物質的量為0.20mol-0.12mol=0.08mol,CO的物質的量為0.22mol-0.12mol=0.1mol,故平衡常數K=$\frac{1}{c(C{H}_{3}OH)•c(CO)}$=$\frac{1}{\frac{0.08}{2}×\frac{0.1}{2}}$=500;
在T3溫度下,C點時反應已達平衡狀態,故正逆反應速率相等,故v(正)=v(逆),
故答案為:500;=;
(4)由曲線Ⅰ可知:T1溫度下,5min時,反應未達平衡狀態,故升高溫度,化學反應速率加快,故甲醇轉化率隨溫度的升高而增大,
故答案為:反應未達平衡狀態,故升高溫度,化學反應速率加快,故甲醇轉化率隨溫度的升高而增大;
(5)原平衡體系,氣體總的物質的量為0.08mol+0.1mol=0.18mol,體積為2L,
在溫度為T2時,往上述達到平衡的恒壓容器中,再在瞬間通入0.12molCH3OH和0.06molCO混合氣體,充入氣體總的物質的量為0.12mol+0.06mol=0.18mol,原平衡相等,故體積變為原來的2倍,此時,甲醇的物質的量為0.08mol+0.12mol=0.2mol,CO的物質的量為0.1mol+0.06mol=0.16mol,則Qc=$\frac{1}{\frac{0.2}{4}×\frac{0.16}{4}}$=500=K,故平衡不移動;
故答案為:不移動;加入氣體的總物質的量與原平衡氣體的總物質的量相等,體積變為4L,Qc=Qc=$\frac{1}{\frac{0.2}{4}×\frac{0.16}{4}}$=500=K;
(6)當時間到達t1時,將該反應體系溫度迅速上升到T3,并維持該溫度,溫度升高,平衡逆向移動,乙酸的物質的量減小,一段時間后達到平衡狀態,乙酸的物質的量保持不變,故t1時刻后的變化總趨勢曲線為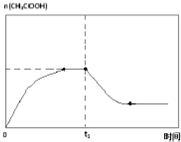 ,故答案為:
,故答案為: .
.
點評 本題考查蓋斯定律的應用、平衡圖象分析、平衡常數的計算機化學平衡移動原理,難度較大.要注意根據濃度商與平衡常數來判斷反應進行的方向.


科目:高中化學 來源: 題型:多選題
| A. | 在苯和液溴的混合物中,添加少量鐵屑后馬上劇烈反應 | |
| B. | 伸出燒瓶的導管要有足夠長度,其作用是導出氣體和充分冷凝回流逸出的苯和溴蒸氣 | |
| C. | 導管末端應插入錐形瓶內水面以下,有利于HBr氣體被吸收 | |
| D. | 反應后燒瓶中是褐色的油狀液體,倒入盛有足量濃燒堿溶液的分液漏斗中,充分振蕩后靜置,上層液體是無色的溴苯 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
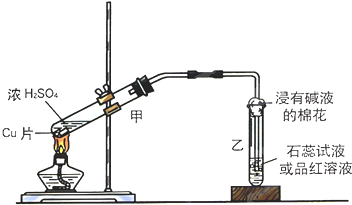 實驗室常用下列裝置來進行銅跟濃硫酸反應等一系列實驗.
實驗室常用下列裝置來進行銅跟濃硫酸反應等一系列實驗.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 X、Y是元素周期表前20號元素,且X的原子序數比Y大4,請填空(X、Y要用具體的元素符號表示):
X、Y是元素周期表前20號元素,且X的原子序數比Y大4,請填空(X、Y要用具體的元素符號表示):查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 乳酸薄荷醇酯(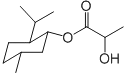 )僅能發生水解、氧化、消去反應 )僅能發生水解、氧化、消去反應 | |
| B. | 乙醛和丙烯醛(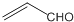 )不是同系物,它們與氫氣充分反應后的產物是同系物 )不是同系物,它們與氫氣充分反應后的產物是同系物 | |
| C. | 乙烯、聚氯乙烯和苯分子中均含有碳碳雙鍵 | |
| D. | CH3COOCH2CH3與CH3CH2COOCH3互為同分異構體,核磁共振氫譜顯示兩者均有三種不同的氫原子且三種氫原子的比例相同,故不能用核磁共振氫譜鑒別 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 銅與濃硫酸反應所得白色固體甲是CuSO4 | |
| B. | 加BaCl2溶液后所得白色沉淀是BaSO3 | |
| C. | 白色固體甲中夾雜的少量黑色物質乙中不可能含有CuO | |
| D. | 白色固體甲中夾雜的少量黑色物質乙中含元素Cu、S |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 圖1表示0.10mol•L-1NaOH溶液滴定20.00mL0.10mol•L-1醋酸溶液的滴定曲線 | |
| B. | 圖2表示乙酸溶液中通入氨氣至過量過程中溶液導電性I的變化 | |
| C. | 根據圖3所示可知:石墨比金剛石穩定 | |
| D. | 圖4表示反應:2SO2+O2?2SO3,t1時刻只減小的SO3的濃度 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 同一周期中的第ⅡA族和第ⅢA族元素的原子序數差一定為1 | |
| B. | L層上的電子數為奇數的元素一定是主族元素 | |
| C. | 同一主族相鄰兩個周期的元素的原子序數差為上一周期所含元素種類 | |
| D. | 族序數等于周期序數的元素一定是金屬元素 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com