
 欲測定某NaOHmol•L-1溶液的物質的量濃度,可用0.100的HCl標準溶液進行中和滴定(用甲基橙作指示劑).
欲測定某NaOHmol•L-1溶液的物質的量濃度,可用0.100的HCl標準溶液進行中和滴定(用甲基橙作指示劑).| 實驗序號 | 待測NaOH溶液的體積/mL | 0.1000mol•L-1HCl溶液的體積/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 0.00 | 26.29 |
| 2 | 25.00 | 1.00 | 31.00 |
| 3 | 25.00 | 1.00 | 27.31 |
分析 (1)滴定操作標準液在滴定管中,待測液盛在錐形瓶中;
(2)酸性溶液存放在酸式滴定管中;
(3)根據滴定終點時溶液顏色由黃色突變為橙色,且保持半分鐘不變色;
(4)根據滴定管的結構與精確度為0.01mL;
(5)先根據數據的有效性,舍去第2組數據,然后求出1、3組平均消耗V(鹽酸),接著根據鹽酸和NaOH反應求出C(NaOH);
(6)根據c(待測)=$\frac{c(標準)×V(標準)}{V(待測)}$分析不當操作對V(標準)的影響,以此判斷.
解答 解:(1)用酸式滴定管取待測待測NaOH溶液于錐形瓶中;
故答案為:錐形瓶;
(2)盛裝標準鹽酸的儀器名稱為酸式滴定管;
故答案為:酸式滴定管;
(3)待測液是氫氧化鈉,錐形瓶中盛有的氫氧化鈉溶液中滴入甲基橙,溶液的顏色是黃色,隨著溶液的pH減小,當滴到溶液的pH小于4.4時,溶液顏色由黃色變成橙色,且半分鐘不褪色,滴到結束,
故答案為:溶液由黃色變為橙色且半分鐘內不褪色;
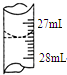
(4)甲學生在實驗過程中,記錄滴定前滴定管內液面讀數為0.50mL,滴定后液面如圖為27.40ml,滴定管中的液面讀數為27.40ml-0.50mL=26.90mL,
故答案為:26.90mL;
(5)根據數據的有效性,舍去第2組數據,則1、3組平均消耗V(鹽酸)=$\frac{26.29mL+26.31mL}{2}$=26.30mL,
HCl+NaOH═NaCl+H2O
0.0263L×0.1000mol•L-1 0.025L×C(NaOH)
則C(NaOH)=$\frac{0.0263L×0.1000mol/L}{0.025L}$=0.1052mol/L;
故答案為:0.1052mol/L;
(6)A.錐形瓶用蒸餾水洗凈后再用待測液潤洗,會使錐形瓶內溶質的物質的量增大,會造成V(標準)偏大,根據c(待測)=$\frac{c(標準)×V(標準)}{V(待測)}$分析,造成c(待測)偏高,故A正確;
B.酸式滴定管用蒸餾水洗凈后再用標準液潤洗,對V(標準)無影響,根據c(待測)=$\frac{c(標準)×V(標準)}{V(待測)}$分析,造成c(待測)不變,故B錯誤;
C.滴定前酸式滴定管尖端氣泡未排除,滴定后氣泡消失,會造成V(標準)偏大,根據c(待測)=$\frac{c(標準)×V(標準)}{V(待測)}$分析,造成c(待測)偏高,故C正確;
D.滴定前讀數正確,滴定后俯視滴定管讀數,會造成V(標準)偏小,根據c(待測)=$\frac{c(標準)×V(標準)}{V(待測)}$分析,造成c(待測)偏低,故D錯誤;
故選AC.
點評 本題考查了酸堿中和滴定實驗的操作步驟、滴定管的結構、終點判斷以及計算應用,終點判斷,題目難度中等.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
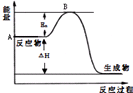 2SO2(g)+O2(g)?2SO3(g)△H=a kJ•mol-1,反應過程的能量變化如圖所示.已知1mol SO2(g)完全轉化為1mol SO3(g)放熱99kJ.請回答:
2SO2(g)+O2(g)?2SO3(g)△H=a kJ•mol-1,反應過程的能量變化如圖所示.已知1mol SO2(g)完全轉化為1mol SO3(g)放熱99kJ.請回答:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 將待測液NaOH溶液取到錐形瓶后,露置空氣中較長時間,以酚酞為指示劑測定 | |
| B. | 以甲基橙為指示劑,當甲基橙變紅時停止滴定 | |
| C. | 移液管用蒸餾水沖洗后直接移取待測液 | |
| D. | 滴定終點讀數時俯視 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
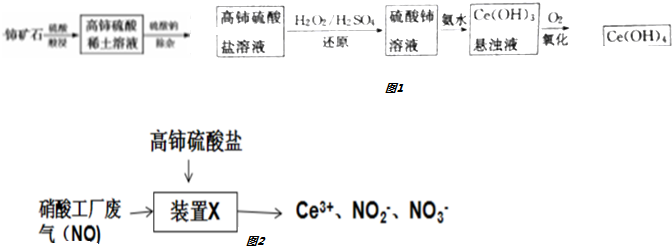
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
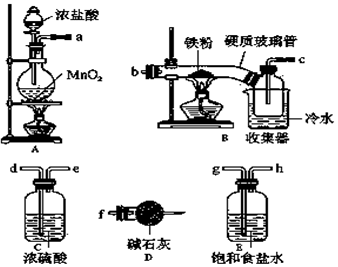
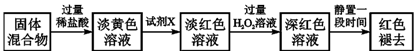
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com