
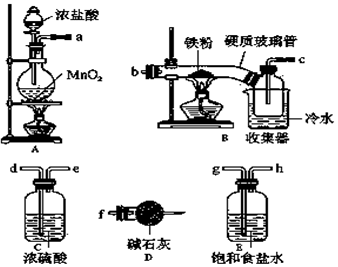
分析 生產無水氯化鐵流程:A裝置:制取氯氣,實驗室常用濃鹽酸與二氧化錳加熱制取MnO2+4HCl(濃)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,裝置E:吸收HCl,裝置C:作用是干燥氯氣,常用濃硫酸,裝置B:鐵和氯氣反應2Fe+3Cl2$\frac{\underline{\;點燃\;}}{\;}$2FeCl3,D裝置尾氣吸收.
(1)排列順序為氣體的制取→洗氣→干燥→氯氣和鐵的反應→尾氣處理,無水FeCl3在空氣中易潮解,加熱易升華.工業上,向500-600℃的鐵屑中通入氯氣可生產無水氯化鐵;向熾熱鐵屑中通入氯化氫可以生產無水氯化亞鐵.裝置A制備氯氣,通過裝置E中飽和食鹽水吸收氯化氫氣體,通過裝置裝置C中的濃硫酸除去水蒸氣,通過裝置B生成氯化鐵后冷卻得到固體污水氯化鐵,最后需要連接裝置D避免空氣中水蒸氣進入裝置B使氯化鐵水解;
(2)i.實驗室利用二氧化錳與濃鹽酸加熱反應制取氯氣;
ii.D中堿石灰的作用是吸收多余污染氣體,防止空氣中水蒸氣進入裝置B;
(3)無水FeCl3在空氣中易潮解,加熱易升華;
(4)①根據Fe3+和KSCN反應生成絡合物硫氰化鐵而使溶液呈血紅色;
②Fe2+被H2O2氧化生成Fe3+,從而增大Fe3+濃度.
解答 解:(1)濃硫酸具有吸水性能作氯氣干燥劑、堿石灰具有堿性而吸收氯氣、飽和食鹽水吸收氯化氫而抑制氯氣溶解,裝置排列順序為氣體的制取→洗氣→干燥→氯氣和鐵的反應→尾氣處理,所以裝置連接順序為a→g→h→d→e→b→c→f,
故答案為:g;h;d;e;f;
(2)i.制取無水氯化鐵的實驗中,A裝置制取的是氯氣,實驗室常用濃鹽酸與二氧化錳加熱制取,離子方程式為:MnO2+2Cl-+4H+$\frac{\underline{\;\;△\;\;}}{\;}$ Mn2++2H2O+Cl2↑,
故答案為:MnO2+2Cl-+4H+$\frac{\underline{\;\;△\;\;}}{\;}$ Mn2++2H2O+Cl2↑,
ii.D中堿石灰的作用是吸收多余污染氣體,防止空氣中水蒸氣進入裝置B,吸收沒有反應完的氯氣,以防污染空氣,吸收空氣中的水蒸氣,防止生成的FeCl3潮解,
故答案為:吸收沒有反應完的氯氣,以防污染空氣;吸收空氣中的水蒸氣,防止生成的FeCl3潮解;
(3)無水FeCl3在空氣中易潮解,加熱易升華,反應結束后,生成的煙狀FeCl3大部分進入收集器,少量沉積在反應管B中硬質玻璃管的右端.要使沉積得FeCl3進入收集器,需進行的操作是在沉積的FeCl3固體下方加熱,
故答案為:在沉積的FeCl3固體下方加熱;
(4)①Fe3+和KSCN反應生成絡合物硫氰化鐵而使溶液呈血紅色,反應方程式為Fe3++3SCN-?Fe(SCN)3,
故答案為:Fe3++3SCN-?Fe(SCN)3;
②Fe2+被H2O2氧化生成Fe3+,從而增大Fe3+濃度,Fe3+、SCN-反應生成Fe(SCN)3,從而增大絡合物濃度,溶液顏色加深,反應的離子方程式為:2Fe2++2H++H2O2═2Fe3++2H2O,
故答案為:2Fe2++2H++H2O2═2Fe3++2H2O.
點評 本題通過探究氯氣與鐵反應,考查了物質性質實驗方案的設計方法,題目難度中等,注意掌握氯氣與鐵反應的現象、反應原理,明確物質性質實驗方案的設計原則,試題充分考查了學生的分析、理解能力及化學實驗能力.


 新課標快樂提優暑假作業陜西旅游出版社系列答案
新課標快樂提優暑假作業陜西旅游出版社系列答案 暑假銜接培優教材浙江工商大學出版社系列答案
暑假銜接培優教材浙江工商大學出版社系列答案 欣語文化快樂暑假沈陽出版社系列答案
欣語文化快樂暑假沈陽出版社系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
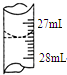 欲測定某NaOHmol•L-1溶液的物質的量濃度,可用0.100的HCl標準溶液進行中和滴定(用甲基橙作指示劑).
欲測定某NaOHmol•L-1溶液的物質的量濃度,可用0.100的HCl標準溶液進行中和滴定(用甲基橙作指示劑).| 實驗序號 | 待測NaOH溶液的體積/mL | 0.1000mol•L-1HCl溶液的體積/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 0.00 | 26.29 |
| 2 | 25.00 | 1.00 | 31.00 |
| 3 | 25.00 | 1.00 | 27.31 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
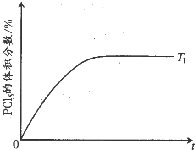
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl5)/mol | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 化學鍵 | H-H | C-O | C═O | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 1076 | 465 | 413 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用惰性電極電解NaH2PO2溶液,其陰極反應式為:2H2O-4e-═O2↑+4H+ | |
| B. | H3PO2與過量NaOH溶液反應的離子方程式為:H3PO2+3OH-═PO23-+3H2O | |
| C. | 將H3PO2溶液加入到酸性重鉻酸鉀溶液中,H3PO2的還原產物可能為H3PO4 | |
| D. | H3PO2溶于水的電離方程式為H3PO2?H++H2PO2- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 標準狀況下,22.4 L H2和Cl2的混合氣體中含有的分子數為2NA | |
| B. | 在標準狀況下,1 mol H2O的體積可能是22.4 L | |
| C. | 當溫度高于0℃時,一定量任何氣體的體積都大于22.4 L | |
| D. | 標況下,某氣體的體積為22.4 L,則該氣體的物質的量為1 mol,所含的分子數目約為:6.02×1023 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NaHCO3=Na++H++CO32- | B. | NH4NO3=NH4++NO3- | ||
| C. | NaHSO4=Na++H++SO42- | D. | Ba(OH)2=Ba2++2OH- |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com