
| 相關信息 | |
| X | 單質為雙原子分子,在空氣中所占體積約為78% |
| Y | 含Y元素的物質焰色反應為黃色 |
| Z | 同周期元素中原子半徑最小 |
| R | R元素原子的最外層電子數是K層電子數的3倍 |
 ;
; ,寫出乙溶液在空氣中變質生成Y2R2的化學方程式4Na2S+O2+2H2O═4NaOH+2Na2S2.
,寫出乙溶液在空氣中變質生成Y2R2的化學方程式4Na2S+O2+2H2O═4NaOH+2Na2S2.分析 I.X、Y、Z、R四種元素均為短周期元素,X單質為雙原子分子,在空氣中所占體積約為78%,則X為N元素;含Y元素的物質焰色反應為黃色,則Y為Na;Z是同周期元素中原子半徑最小,且Y、Z、R同周期,則Z為Cl,R元素原子的最外層電子數是K層電子數的3倍,則R為S元素;
Ⅱ.X為N元素,元素X與氫可形成多種化合物,如丙、丁、戊,丙與醋酸類似,為一元弱酸,設丙的分子式為HNm,HNm分解的方程式為2HNm=H2+mN2,8.6gHNm爆炸分解生成H2和6.72L(標況下)N2,氮氣為$\frac{6.72L}{22.4L/mol}$=0.3mol,則2:m=$\frac{8.6}{1+14m}$:0.3,解得m=3,所以丙為HN3,丁為離子化合物,遇水反應生成H2和氣體戊,標況下戊的密度為0.76g•L-1,則戊的相對分子質量為0.76×22.4=17,所以戊為氨氣,則丁為NH4H;
Ⅲ.Fe3+在溶液中分步水解,第一步水解程度最大,水解程度依次減小.
解答 解:I.X、Y、Z、R四種元素均為短周期元素,X單質為雙原子分子,在空氣中所占體積約為78%,則X為N元素;含Y元素的物質焰色反應為黃色,則Y為Na;Z是同周期元素中原子半徑最小,且Y、Z、R同周期,則Z為Cl,R元素原子的最外層電子數是K層電子數的3倍,則R為S元素.
(1)Z為Cl,Z元素在周期表的位置是第三周期第ⅦA族,離子電子層數越多,離子半徑越大,電子層結構相同時,核電荷數越多,離子半徑越小,所以Y、Z、R簡單離子的半徑從大到小的順序是 S2->Cl->Na+,
故答案為:第三周期第ⅦA族; S2->Cl->Na+;
(2)由N、Cl兩種元素組成的化合物甲,常溫下為易揮發的淡黃色液體,甲分子構型為三角錐形,且分子里N、Cl兩種原子最外層均達到8個電子的穩定結構,則N、Cl個數比應為1:3,甲遇水蒸氣可形成一種常見的漂白性物質應為次氯酸,所以在甲中氯顯+1價,所以甲的結構式為 ,
,
故答案為: ;
;
(3)化合物乙為Na2S溶液在空氣中長期放置,與氧氣反應會生成Na2S2,則Na2S2的電子式為 ,Na2S溶液在空氣中變質過程的化學方程式為4Na2S+O2+2H2O═4NaOH+2Na2S2,
,Na2S溶液在空氣中變質過程的化學方程式為4Na2S+O2+2H2O═4NaOH+2Na2S2,
故答案為: ;4Na2S+O2+2H2O═4NaOH+2Na2S2;
;4Na2S+O2+2H2O═4NaOH+2Na2S2;
Ⅱ.X為N元素,元素X與氫可形成多種化合物,如丙、丁、戊,
(4)X為N元素,元素X與氫可形成多種化合物,如丙、丁、戊,丙與醋酸類似,為一元弱酸,設丙的分子式為HNm,HNm分解的方程式為2HNm=H2+mN2,8.6gHNm爆炸分解生成H2和6.72L(標況下)N2,氮氣為$\frac{6.72L}{22.4L/mol}$=0.3mol,則2:m=$\frac{8.6}{1+14m}$:0.3,解得m=3,所以丙為HN3,反應方程式為:2HN3=3N2+H2 ,
故答案為:2HN3=3N2+H2 ;
(5)丁為離子化合物,遇水反應生成H2和氣體戊,標況下戊的密度為0.76g•L-1,則戊的相對分子質量為0.76×22.4=17,所以戊為氨氣,則丁為NH4H,
故答案為:NH4H;
Ⅲ.Fe3+在溶液中分步水解,第一步水解程度最大,各步水解程度依次減小,水解反應的平衡常數 K1、K2、K3 由大到小的順序是:K1>K2>K3,
故答案為:K1>K2>K3.
點評 本題考查元素化合物推斷,推斷元素是解題關鍵,問題中涉及的物質中學基本不涉及,側重考查學生知識遷移應用與分析推理能力,難度中等.


 中考利劍中考試卷匯編系列答案
中考利劍中考試卷匯編系列答案 教育世家狀元卷系列答案
教育世家狀元卷系列答案 黃岡課堂作業本系列答案
黃岡課堂作業本系列答案 單元加期末復習先鋒大考卷系列答案
單元加期末復習先鋒大考卷系列答案科目:高中化學 來源: 題型:選擇題
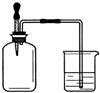 如右圖所示,集氣瓶 內充滿某混合氣體,置于光亮處,將滴管內的水擠入集氣瓶后,燒杯中的水會進入集氣瓶,集氣瓶內氣體是( )
如右圖所示,集氣瓶 內充滿某混合氣體,置于光亮處,將滴管內的水擠入集氣瓶后,燒杯中的水會進入集氣瓶,集氣瓶內氣體是( )| A. | ①② | B. | ②④ | C. | ②③ | D. | ③④ |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
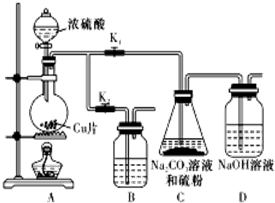 硫代硫酸鈉(Na2S2O3)可由亞硫酸鈉和硫粉通過化合反應制得.已知:Na2S2O3在酸性溶液中不能穩定存在.
硫代硫酸鈉(Na2S2O3)可由亞硫酸鈉和硫粉通過化合反應制得.已知:Na2S2O3在酸性溶液中不能穩定存在.| 編號 | 1 | 2 | 3 | 4 |
| 溶液的體積/mL | 10.00 | 10.00 | 10.00 | 10.00 |
| 消耗I2標準溶液的體積/mL | 19.99 | 19.98 | 17.13 | 20.03 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 弱酸化學式 | CH3COOH | HCN | H2CO3 |
| 電離平衡常數(25℃) | 1.8×l0-5 | 4.9×l0-10 | K1=4.3×l0-7K2=5.6×l0-11 |
| A. | 向NaCN 溶液中通入少量CO2發生的離子反應為:2CN-+H2O+CO2═2HCN+CO32- | |
| B. | 等物質的量濃度的各溶液pH關系為:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) | |
| C. | a mol/LHCN溶液與b mol/LNaOH溶液等體積混合后,所得溶液中c(Na+)>c(CN-),則b一定大 于a | |
| D. | NaHCO3和Na2CO3的混合溶液中,一定存在:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在 c(HCO3-)=0.1 mol•L-1 的溶液中:NH4+、AlO2-、Cl-、NO3- | |
| B. | 在由水電離出的 c(H+)=l×l0-12 mol•L-1 的溶液中:Cu2+、ClO-、Na+、SO42- | |
| C. | 在加入鋁粉產生 H2 的溶液中:SO42-、NO3-、Na+、NH4+ | |
| D. | 在使紅色石蕊試紙變藍的溶液中:SiO32-、CO32-、Na+、F- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
. .
. .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 組別 | 溫度 | KI溶液 | H2SO4溶液 | 淀粉溶液 | 實驗目的 | ||
| C(KI) | V | C(H2SO4) | V | ||||
| 1 | 298K | 1mol/L | 5mL | 0.1mol/L | 5mL | 3滴 | l組和2組探究②溫度對該反應速率的影響;1組和3組探究反應物濃度對該反應速率的影響 |
| 2 | 308K | 1mol/L | 5mL | 0.1mol/L | 5mL | 3滴 | |
| 3 | 298K | 1mol/L | 5mL | ①0.2mol/L硫酸 | 5mL | 3滴 | |
| 實驗方案 | 預期實驗現象與結論 |
| 取少量碘水于試管中,滴入幾滴淀粉 溶液,然后逐滴加入1mol/L KOH溶液,觀察現象 | 若藍色不褪色,則假設二正確 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1mol KClO3 參加反應有2mol電子轉移 | |
| B. | ClO2是氧化產物 | |
| C. | H2C2O4的氧化性強于ClO2的氧化性 | |
| D. | KClO3 在反應中得到電子,作氧化劑 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 水電離產生的H+濃度為1×10-12mol•L-1的溶液:NH4+、Na+、Cl-、HCO3- | |
| B. | 能使pH試紙變深藍色的溶液:Na+、AlO2-、S2-、CO32- | |
| C. | 含有大量Fe3+的溶液:SCN-、I-、K+、Br- | |
| D. | pH=1的水溶液中:Al3+、NH4+、CH3COO-、Br- |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com