
容器 | 容積/L | 溫度/℃ | 起始量/mol | 平衡量/mol | 達到平衡所需時間/min | 平衡常數(shù) | |
| C(s) | H2O(g) | H2(g) | |||||
| 甲 | 2 | T1 | 2 | 4 | 3.2 | 3.5 | K1 |
| 乙 | 1 | T2 | 1 | 2 | 1.2 | 3 | K2 |
| A. | T1<T2 | |
| B. | K2=1.35 mol•L-1(或K2=1.35) | |
| C. | 混合氣體的密度始終保持不變 | |
| D. | 乙容器中,當反應進行到1.5 min時,n(H2O)=1.4 mol. |
分析 A.運用平衡移動的原理來分析溫度的高低;
B.利用三段式計算平衡時各組分的物質的量,再根據(jù)平衡常數(shù)K2計算;
C.該反應有固體參與,因此反應不平衡,氣體的質量就會變化,根據(jù)ρ=$\frac{m}{V}$分析;
D.隨反應進行,物質的濃度降低,反應速率較短,故前1.5min水的濃度變化量大于后1.5min水的濃度變化量.
解答 解:A.兩者反應物濃度相等,甲相對乙,甲平衡時H2(g)平衡量為2.4mol,實際上是3.2mol,說明溫度改變平衡正向移動,而正反應為吸熱反應,所以T1>T2,故A錯誤;
B.由表中數(shù)據(jù)可知,平衡時氫氣的物質的量為1.2mol,則:
C(s)+2H20(g)?C02(g)+2H2(g)
開始(mol):1 2 0 0
轉化(mol):0.6 1.2 0.6 1.2
平衡(mol):0.4 0.8 0.6 1.2
平衡常數(shù)K2=$\frac{0.6×1.{2}^{2}}{0.{8}^{2}}$=1.35,故B正確;
C.該反應有固體參與,因此反應不平衡,氣體的質量就會變化,氣體的體積不變,由$ρ=\frac{m}{V}$可知混合氣體的密度是變量,故C錯誤;
D.3min內(nèi)水蒸氣的濃度變化量=氫氣的濃度變化量的=$\frac{1.2mol}{1L}$=1.2mol/L,隨反應進行,物質的濃度降低,反應速率變小,故前1.5min水的濃度變化量大于后1.5min水的濃度變化量,故反應進行到1.5min時,H2O(g)的物質的量濃度小于2mol/L-1.2mol/L×$\frac{1}{2}$=1.4mol/L,故D錯誤;
故選B.
點評 本題考查化學平衡,為高頻考點,綜合性較強,題目難度中等,其中化學平衡的影響因素和化學平衡常數(shù)的計算是難點.


科目:高中化學 來源: 題型:多選題
| A. | 電解NaOH溶液時,溶液濃度將增大,pH增大 | |
| B. | 電解H2SO4溶液時,溶液濃度將增大,pH增大 | |
| C. | 電解Na2SO4溶液時,溶液濃度將增大,pH不變 | |
| D. | 電解NaCl溶液時,溶液濃度將減小,pH不變 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
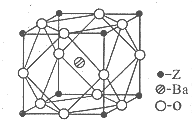 A、B、C、D、Z為周期表前四周期元素,原子序數(shù)依次遞增,已知:
A、B、C、D、Z為周期表前四周期元素,原子序數(shù)依次遞增,已知:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
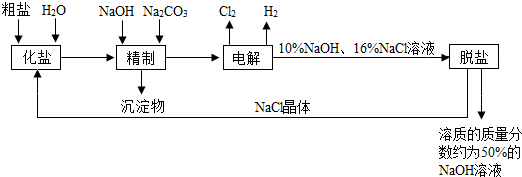
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 元素代號 | 部分特征 |
| A | 單質為相同條件下密度最小的氣體 |
| B | 基態(tài)原子最外層電子排布式為nsnnpn |
| C | 與元素E處于同一周期且電負性僅次于E |
| D | 位于第三周期且第一電離能最小 |
| E | 雙原子分子單質在標準狀況下密度為1.4285g/L |
| F | 生活中常用的金屬,在空氣中表面通常形成一層致密的氧化膜 |
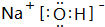 ;F的氧化物既可以和強酸反應也可以和強堿反應,試寫出其氧化物與NaOH溶液反應的離子方程式Al2O3+2OH-=2AlO2-+H2O.
;F的氧化物既可以和強酸反應也可以和強堿反應,試寫出其氧化物與NaOH溶液反應的離子方程式Al2O3+2OH-=2AlO2-+H2O.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 納米銅比納米鐵金屬活動性更強 | |
| B. | 納米銅在反應中可能作氧化劑 | |
| C. | 納米TiO2在不同溶劑中均形成了膠體 | |
| D. | 納米TiO2有很強的氯化性 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 滴定次數(shù) | 待測溶液A的體積(mL) | KMnO4標準溶液的體積 | |
| 滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
| 第一次 | 20.00 | 0.10 | 20.12 |
| 第二次 | 20.00 | 2.20 | 24.20 |
| 第三次 | 20.00 | 4.30 | 24.28 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Mg2+、Cl-、Na+、NO3- | B. | K+、Na+、NO3-、HCO3- | ||
| C. | Na+、K+、Cl-、NO3- | D. | Fe3+、Na+、AlO2-、SO42- |
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com