
 A、B、C、D、Z為周期表前四周期元素,原子序數依次遞增,已知:
A、B、C、D、Z為周期表前四周期元素,原子序數依次遞增,已知:分析 A、B、C、D、Z為周期表前四周期元素,原子序數依次遞增.已知:①A為元素周期表中原子半徑最小的元素,則A為H元素;②B的基態原子中電子占據三種能量不同的原子軌道,且每種軌道中的電子總數相同,原子核外電子排布為1s22s22p2,則B為C元素;③D的基態原子的核外成對電子數是未成對電子數的3倍,核外電子排布式為1s22s22p4,D為O元素;結合原子序數可知,C為N元素;④Z有“生物金屬”之稱,Z4+離子和氬原子的核外電子排布相同,原子序數為22,則Z為Ti元素;⑤A、B、D三種元素組成的一種化合物M是新裝修居室中常含有的一種有害氣體,A、B兩種元素組成的原子個數比為1:1的化合物N是中學化學中常見的有機溶劑,則M為HCHO,N為C6H6,據此解答.
解答 解:A、B、C、D、Z為周期表前四周期元素,原子序數依次遞增.已知:①A為元素周期表中原子半徑最小的元素,則A為H元素;②B的基態原子中電子占據三種能量不同的原子軌道,且每種軌道中的電子總數相同,原子核外電子排布為1s22s22p2,則B為C元素;③D的基態原子的核外成對電子數是未成對電子數的3倍,核外電子排布式為1s22s22p4,D為O元素;結合原子序數可知,C為N元素;④Z有“生物金屬”之稱,Z4+離子和氬原子的核外電子排布相同,原子序數為22,則Z為Ti元素;⑤A、B、D三種元素組成的一種化合物M是新裝修居室中常含有的一種有害氣體,A、B兩種元素組成的原子個數比為1:1的化合物N是中學化學中常見的有機溶劑,則M為HCHO,N為C6H6.
(1)化合物M為HCHO,碳原子的孤電子對數為0,碳原子的σ鍵數為3,則碳原子采取sp2雜化,空間結構為平面三角形,化合物N為苯,由苯分子直接構成的,則N在固態時的晶體類型為分子晶體,
故答案為:平面三角形;sp2;分子晶體;
(2)B、C、D三種元素的分別為C、N、O,同周期元素從左到右元素的第一電離能呈增大趨勢,則C元素的最小,但N原子的電子排布中2p軌道為半滿穩定狀態,能量較低,則失去1個電子更難,第一電離能高于O元素,故第一電離能C<O<N,
故答案為:C<O<N;
(3)與CO2互為等電子體的分子為N2O,
故答案為:N2O;
(4)由C、N、O三種元素所組成的CNO-離子在酸性條件下可與NaClO反應,生成N2、CO2等物質.上述反應的離子方程式為:2CNO-+2H++3ClO-═N2↑+2CO2↑+3C1-+H2O,
故答案為:2CNO-+2H++3ClO-═N2↑+2CO2↑+3C1-+H2O;
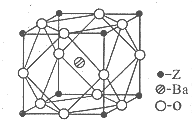
(5)Z為Ti,核外電子數為22,原子基態時的電子排布式為:1s22s22p63s23p63d24s2,外圍電子排布式為3d24s2,由晶體結構圖可知,晶體內與每個Z原子等距離且最近的氧原子在棱的位置,關于Z原子對稱,則氧原子數為3×2=6,Ba原子數目為1,Ti原子數目為$8×\frac{1}{8}=1$,O原子數目為$12×\frac{1}{4}$=3,故化學式為BaTiO3,
故答案為:3d24s2;6; BaTiO3.
點評 本題是對物質結構的考查,涉及分子結構、雜化軌道、電離能、核外電子排布式、晶胞結構等,推斷元素是解題關鍵,注意理解同周期元素中第一電離能發生異常情況,難度中等.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 氮化硅是一種重要的結構陶瓷材料,具有優良性能.
氮化硅是一種重要的結構陶瓷材料,具有優良性能.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 光導纖維和計算機芯片的材料都是二氧化硅 | |
| B. | 蛋白質只含C、H、O、N四種元素 | |
| C. | 可用酸性高錳酸鉀溶液除去乙烷中的乙烯 | |
| D. | 液溴易揮發,在存放液溴的試劑瓶中應加水“液封” |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
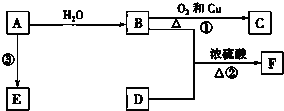 已知A的產量通常用來衡量一個國家的石油化工發展水平,B、D是飲食中兩種常見的有機物,F是一種有香味的物質,F中碳原子數是D的兩倍.現以A為主要原料合成F和高分子化合物E,其合成路線如圖所示.
已知A的產量通常用來衡量一個國家的石油化工發展水平,B、D是飲食中兩種常見的有機物,F是一種有香味的物質,F中碳原子數是D的兩倍.現以A為主要原料合成F和高分子化合物E,其合成路線如圖所示.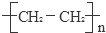 ,反應類型:加聚反應.
,反應類型:加聚反應.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
容器 | 容積/L | 溫度/℃ | 起始量/mol | 平衡量/mol | 達到平衡所需時間/min | 平衡常數 | |
| C(s) | H2O(g) | H2(g) | |||||
| 甲 | 2 | T1 | 2 | 4 | 3.2 | 3.5 | K1 |
| 乙 | 1 | T2 | 1 | 2 | 1.2 | 3 | K2 |
| A. | T1<T2 | |
| B. | K2=1.35 mol•L-1(或K2=1.35) | |
| C. | 混合氣體的密度始終保持不變 | |
| D. | 乙容器中,當反應進行到1.5 min時,n(H2O)=1.4 mol. |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | pH=11的氨水與pH=3的鹽酸等體積混合:c(Cl-)=c(NH4+)>c(OH-)=c(H+) | |
| B. | 0.2mol/L的CH3COOH溶液與0.1mol/L的NaOH溶液等體積混合:2c(Na+)=c(CH3COO-) | |
| C. | 濃度均為0.10mol/L的氨水和氯化銨溶液等體積混合后:c(NH3•H2O)+c(NH4+)=0.1mol/L | |
| D. | pH=3的鹽酸和pH=11的氫氧化鋇等體積混合pH>7 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com