
分析 (1)因為20ml濾液與足量鐵粉生成22.4ml氫氣,其中氫氣的物質的量為$\frac{22.4×0.001}{22.4}$=0.001mol,即20ml濾液中含有0.001×2=0.002mol氫離子,所以濾液中氫離子濃度為$\frac{0.002}{20×0.001}$=0.1mol/L,由此求溶液的pH;
(2)因為氫氧化鋇質量為5.13克,即0.03mol,而生成的硫酸鋇沉淀只有5.825克,即0.025mol,故原溶液中有硫酸根離子0.025mol,所以原混合液中硫酸根離子濃度為$\frac{0.025mol}{100×0.001L}$=0.25mol/L,因為Ba(OH)2+H2SO4=BaSO4 ↓+2H2O,氫氧化鋇與硫酸反應后剩余0.005mol,0.005mol氫氧化鋇將與鹽酸完全反應,而后剩余的鹽酸可以與鐵完全反應生成0.001×5=0.005mol氫氣,這里氫離子的總和為0.005×2+0.005×2=0.02mol,由此分析求解.
解答 解:(1)因為20ml濾液與足量鐵粉生成22.4ml氫氣,其中氫氣的物質的量為$\frac{22.4×0.001}{22.4}$=0.001mol,即20ml濾液中含有0.001×2=0.002mol氫離子,所以濾液中氫離子濃度為$\frac{0.002}{20×0.001}$=0.1mol/L,所以濾液pH為 pH=-lg0.1=1.即濾液pH為1,
答:濾液的pH為1;
(2)因為氫氧化鋇質量為5.13克,即0.03mol,而生成的硫酸鋇沉淀只有5.825克,即0.025mol,故原溶液中有硫酸根離子0.025mol,所以原混合液中硫酸根離子濃度為$\frac{0.025mol}{100×0.001L}$=0.25mol/L,因為Ba(OH)2+H2SO4=BaSO4 ↓+2H2O,氫氧化鋇與硫酸反應后剩余0.005mol,0.005mol氫氧化鋇將與鹽酸完全反應,而后剩余的鹽酸可以與鐵完全反應生成0.001×5=0.005mol氫氣,這里氫離子的總和為0.005×2+0.005×2=0.02mol,因為這里的氫離子全由鹽酸提供,即氯離子也是0.02mol,
故氯離子濃度為$\frac{0.02}{100×0.001}$=0.2mol/L,
答:原混合液中氯離子濃度為 0.2mol/L,硫酸根離子的濃度為0.25mol/L.
點評 本題考查化學方程式的計算,難度中等,清楚發生的反應是關鍵,注意根據離子方程式計算生成氫離子的物質的量.


科目:高中化學 來源: 題型:多選題
| A. | 電解NaOH溶液時,溶液濃度將增大,pH增大 | |
| B. | 電解H2SO4溶液時,溶液濃度將增大,pH增大 | |
| C. | 電解Na2SO4溶液時,溶液濃度將增大,pH不變 | |
| D. | 電解NaCl溶液時,溶液濃度將減小,pH不變 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 序號 | 實驗內容 | 實驗目的 |
| A | 常溫下,測得飽和Na2CO3溶液的pH大于飽和 NaHCO3溶液的pH | 比較常溫下水解程度: CO32->HCO3- |
| B | 向2mL甲苯中加入3滴KMnO4酸性溶液,振蕩; 向2mL己烷中加入3滴KMnO4酸性溶液,振蕩 | 證明與苯環相連的甲基易被氧化 |
| C | 向25mL冷水和沸水中分別滴入5滴FeCl3飽和溶 液,前者為黃色,后者為紅褐色 | 證明溫度升高,Fe3+的水解程度 增大 |
| D | 向盛有10滴0.1mol/LAgNO3溶液的試管中滴加0.1mol/L NaCl溶液,至不再有沉淀生成,再向其中滴加0.1mol/L Na2S溶液 | 證明AgCl沉淀能轉化為溶解度更小 的Ag2S沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 2 mol H2(g)與1 mol O2(g)所具有的總能量比2 mol H2O(g) 所具有的總能量低 | |
| B. | 氫氣的燃燒熱為△H=-241.8 kJ•mol-1 | |
| C. | H2O(g)生成H2O(l)時,斷鍵吸收的能量小于成鍵放出的能量 | |
| D. | 液態水分解的熱化學方程式為:2H2O(l)═2H2(g)+O2(g)△H=+571.6 kJ•mol-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
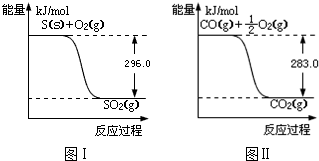
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
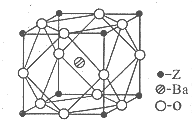 A、B、C、D、Z為周期表前四周期元素,原子序數依次遞增,已知:
A、B、C、D、Z為周期表前四周期元素,原子序數依次遞增,已知:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
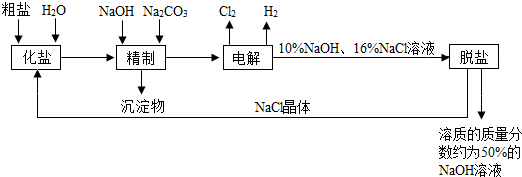
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 滴定次數 | 待測溶液A的體積(mL) | KMnO4標準溶液的體積 | |
| 滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
| 第一次 | 20.00 | 0.10 | 20.12 |
| 第二次 | 20.00 | 2.20 | 24.20 |
| 第三次 | 20.00 | 4.30 | 24.28 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com