
| A. | 化學計量數的關系:b<c | |
| B. | 容器的容積減小后,該反應的逆反應速率減小 | |
| C. | 原容器中用B濃度變化表示該反應在1 min內的速率為$\frac{cx}{b}$mol•(L•min)-1 | |
| D. | 若保持溫度和容器容積不變,充入氦氣(不參與反應),平衡不發生移動 |
分析 反應2A(s)+bB(g)?cC(g),1min時達到平衡,C的濃度為x mol•L-1.若保持溫度不變,將密閉容器的容積壓縮為原來的$\frac{1}{2}$,重新達到平衡后,C的濃度為2.5x mol•L-1,則體積縮小時壓強增大,C的濃度大于2xmol/L,即增大壓強,化學平衡正向移動,以此來解答.
解答 解:反應2A(s)+bB(g)?cC(g),1min時達到平衡,C的濃度為x mol•L-1.若保持溫度不變,將密閉容器的容積壓縮為原來的$\frac{1}{2}$,重新達到平衡后,C的濃度為2.5x mol•L-1,則體積縮小時壓強增大,C的濃度大于2xmol/L,即增大壓強,化學平衡正向移動,
A.增大壓強,化學平衡向氣體體積縮小的方向移動,所以b>c,故A錯誤;
B.容器的容積減小后,反應物的濃度增大,壓強增大,所以該反應的逆反應速率增大,故B錯誤;
C.1min時達到平衡,C的濃度為x mol•L-1,v(C)=xmol•L-1•min-1,由反應速率之比等于化學計量數之比可知,v(B)=$\frac{bx}{c}$mol•L-1•min-1,故C錯誤;
D.若保持溫度和容器的容積不變,充入氦氣(不參與反應),反應體系中各物質的濃度不變,平衡不移動,故D正確;
故選C.
點評 本題考查化學平衡的計算,明確體積縮小時C的濃度變化來判斷平衡移動的方向是解答本題的關鍵,題目難度中等.


 字詞句篇與同步作文達標系列答案
字詞句篇與同步作文達標系列答案科目:高中化學 來源: 題型:選擇題
| A. | 20 mol•L-1•s-1 | B. | 40 mol•L-1•s-1 | C. | 60 mol•L-1•s-1 | D. | 150mol•L-1•s-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. |  根據圖可判斷正反應的△H<0 | |
| B. |  根據圖,除去CuSO4溶液中的Fe3+,可加入CuO調節pH至3~5 | |
| C. | 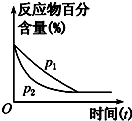 圖可表示壓強(p)對反應2A(g)+2B(g)?3C(g)+D(s)的影響 | |
| D. |  圖為水的電離平衡曲線圖,若從A點到C點,可采用在水中加入適量NaOH固體的方法 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 達到化學平衡時v正(O2)=v逆(NO) | |
| B. | 若單位時間內生成xmolNO的同時生成 xmolNH3,則反應達到平衡狀態 | |
| C. | 達化學平衡時,若增大容器體積,則正反應速率減小,逆反應速率增大 | |
| D. | 若反應發生在體積恒定的密閉容器中,當密度不變時,化學反應達到平衡狀態 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 實驗室中“通風廚”能排出有害的氣體,能防止有害氣體污染大氣環境 | |
| B. | 減少碳氫化合物、氮氧化物的排放可以有效的防止光化學煙霧的產生 | |
| C. | 處理廢棄塑料制品較為合理的方法是用化學方法將廢棄塑料加工成防水涂料或汽油 | |
| D. | 對廢棄電池進行集中回收后處理的主要目的是防止重金離子的污染 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 電解時可以精銅為陽極,以CuSO4溶液為電解液 | |
| B. | 電解時陰極發生還原反應 | |
| C. | 粗銅連接電源負極,其電極反應是Cu-2e-=Cu2+ | |
| D. | 電解結束后,電解質溶液的濃度保持不變 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 共價鍵 | H-H | N-H | N≡N |
| 能量變化/kJ•mol-1 | 436 | 390.8 | 946 |
| NH3質量分數17%的氨水 | 無水NH4HSO3 | |
| 價格(元/kg) | 1.0 | 1.8 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com