
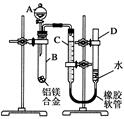
 某學習小組用如圖所示裝置測定鋁鎂合金中鋁的質量分數和鋁的相對原子質量.
某學習小組用如圖所示裝置測定鋁鎂合金中鋁的質量分數和鋁的相對原子質量.分析 測定鋁鎂合金中鋁的質量分數和鋁的相對原子質量,因Mg與NaOH不反應,而Al與Na反應,由實驗可知,A中為NaOH溶液,B中發生2Al+2NaOH+2H2O=2NaAlO2+3H2↑,C、D為量氣裝置,B中剩余固體為Mg,固體質量差為Al的質量,利用氫氣的體積可計算鋁的質量分數和鋁的相對原子質量.
解答 解:Mg與NaOH不反應,而Al與Na反應,由實驗可知,A中為NaOH溶液,B中發生2Al+2NaOH+2H2O=2NaAlO2+3H2↑,C、D為量氣裝置,
(1)由上述分析可知,A為NaOH溶液,故答案為:NaOH溶液;
(2)B中發生反應的化學方程式為2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故答案為:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(3)B中剩余固體的質量為c g,為Mg的質量,則Al的質量為(a-c)g,則鋁的質量分數為$\frac{(a-c)}{a}$×100%;
測得氫氣體積為b mL,其物質的量為$\frac{b×1{0}^{-3}L}{22.4L/mol}$,由2Al+2NaOH+2H2O=2NaAlO2+3H2↑可知,Al的物質的量為$\frac{b×1{0}^{-3}L}{22.4L/mol}$×$\frac{2}{3}$=$\frac{b}{33600}$mol,則Al的摩爾質量為$\frac{(a-c)g}{\frac{b}{33600}mol}$=$\frac{33600(a-c)}{b}$g/mol,所以鋁的相對原子質量為$\frac{33600(a-c)}{b}$,
故答案為:$\frac{33600(a-c)}{b}$;
(4)若未洗滌過濾所得的不溶物,c值偏大,則造成(a-c)變小,由鋁的質量分數為$\frac{(a-c)}{a}$×100%可知,實驗過程中鋁的質量分數偏小,
故答案為:偏小.
點評 本題考查物質含量的測定,為高頻考點,涉及Al的化學性質、化學反應方程式的計算等,綜合性較強,側重分析、實驗與計算能力的考查,題目難度中等.


 舉一反三單元同步過關卷系列答案
舉一反三單元同步過關卷系列答案科目:高中化學 來源: 題型:選擇題
| A. | 反應的還原產物是N2 | |
| B. | 消耗1 mol氧化劑,轉移電子3 mol | |
| C. | 氧化劑與還原劑的物質的量之比為2:3 | |
| D. | 反應后溶液的酸性明顯增強 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 常溫下,將濃度為0.02mol•L-1的MOH溶液逐滴滴入100mL 0.01mol•L-1HA溶液中,溶液pH隨MOH溶液體積變化如圖所示,若忽略溶液混合時體積的變化,下列敘述正確的是( )
常溫下,將濃度為0.02mol•L-1的MOH溶液逐滴滴入100mL 0.01mol•L-1HA溶液中,溶液pH隨MOH溶液體積變化如圖所示,若忽略溶液混合時體積的變化,下列敘述正確的是( )| A. | 忽略溫度影響,滴入MOH溶液過程中,水的電離程度不變 | |
| B. | HA為弱酸,MOH為強堿 | |
| C. | N點MOH過量,故溶液中c(M+)>c(A-) | |
| D. | K點的c(MOH)+c(M+)=0.01 mol•L-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 不同時間各物質的物質的量/mol | ||||
| 0min | 2min | 4min | 6min | |
| CH4 | 2.00 | 1.76 | 1.60 | n2 |
| H2 | 0.00 | 0.72 | n1 | 1.20 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.1mol/L | B. | 0.2mol/L | C. | 0.3mol/L | D. | 0.4mol/L |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com