
| 溫度/K | 反應Ⅰ | 反應Ⅱ | 已知: K1>K2>K1′>K2′ |
| 298 | K1 | K2 | |
| 328 | K1′ | K2′ |
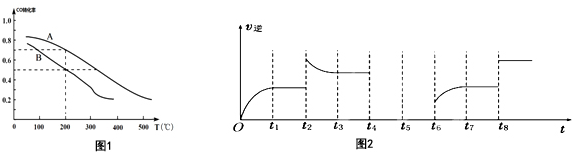
分析 (1)反應I的正反應為氣體物質的量減小的反應,混亂度減小;
化學平衡常數是指:一定溫度下,可逆反應到達平衡時,生成物的濃度系數次冪之積與反應物的濃度系數次冪之積的比,固體、純液體不需要在化學平衡常數中寫出;
反應Ⅲ=Ⅰ×2+Ⅱ,則K3=K12×K2,由表中數據可知,K1、K2均隨溫度升高而減小,則K3也隨溫度升高而減小,說明正反應為放熱反應;
(2)反應消耗了H2O(g)有利于反應Ⅱ、Ⅲ正向移動;同時此反應生成了H2,有利于反應I、Ⅲ正向移動;
(3)正反應為氣體體積減小的反應,增大壓強平衡正向移動,CO的轉化率增大,故B表示0.1MPa、A表示5.0MPa,壓強為0.1MPa、溫度為200℃時,CO的轉化率為0.5,再計算平衡時CO的物質的量、混合氣體總物質的量,進而計算CO的物質的量分數;
(4)①t2時改變條件瞬間,逆反應速率增大,而后減小,平衡逆向移動,正反應為氣體體積減小的放熱反應,增大壓強平衡正向移動,可能是升高溫度,也可能是增大生成物的濃度;
②若t4擴大容器體積,濃度減小,瞬間反應速率減小,平衡逆向移動,t5達到平衡,t6時增大反應物濃度,瞬間逆反應速率不變,而后逆反應速率增大.
解答 解:(1)反應I的正反應為氣體物質的量減小的反應,混亂度減小,則△S<0;
反應Ⅱ:2CH3OH(g)?CH3OCH3(g)+H2O(g)的化學平衡常數表達式K=$\frac{c(C{H}_{3}OC{H}_{3})×c({H}_{2}O)}{{c}^{2}(C{H}_{3}OH)}$;
反應Ⅲ=Ⅰ×2+Ⅱ,則K3=K12×K2,由表中數據可知,K1、K2均隨溫度升高而減小,則K3也隨溫度升高而減小,說明正反應為放熱反應,
故答案為:<;$\frac{c(C{H}_{3}OC{H}_{3})×c({H}_{2}O)}{{c}^{2}(C{H}_{3}OH)}$;放熱;
(2)反應消耗了H2O(g)有利于反應Ⅱ、Ⅲ正向移動;同時此反應生成了H2,有利于反應I、Ⅲ正向移動,所以能提高CH3OCH3的產率,
故答案為:反應消耗了H2O(g)有利于反應Ⅱ、Ⅲ正向移動;同時此反應生成了H2,有利于反應I、Ⅲ正向移動;
(3)正反應為氣體體積減小的反應,增大壓強平衡正向移動,CO的轉化率增大,故B表示0.1MPa、A表示5.0MPa,壓強為0.1MPa、溫度為200℃時,CO的轉化率為0.5,設起始時n(CO)=1mol、n(H2)=2mol,則轉化的CO為0.5mol,
CO(g)+2H2(g)?CH3OH(g)
起始量(mol):1 2 0
變化量(mol):0.5 1 0.5
平衡量(mol):0.5 1 0.5
平衡混合氣中甲醇的物質的量分數是$\frac{0.5mol}{(0.5+1+0.5)mol}$×100%=25%,
故答案為:25%;
(4)①t2時改變條件瞬間,逆反應速率增大,而后減小,平衡逆向移動,正反應為氣體體積減小的放熱反應,增大壓強平衡正向移動,可能是升高溫度,也可能是增大生成物的濃度,
故答案為:升高溫度; 增大生成物濃度;
②若t4擴大容器體積,濃度減小,瞬間反應速率減小,平衡逆向移動,t5達到平衡,t6時增大反應物濃度,瞬間逆反應速率不變,而后逆反應速率增大,速率變化曲線為: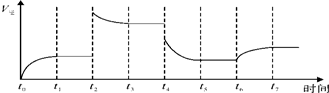 ,
,
故答案為: .
.
點評 本題考查化學平衡計算與影響因素、反應速率影響因素、化學平衡圖象、平衡常數等,理解掌握平衡移動原理.


 鷹派教輔銜接教材河北教育出版社系列答案
鷹派教輔銜接教材河北教育出版社系列答案 初中暑期銜接系列答案
初中暑期銜接系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
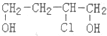 )是合成高分子化合物HPMA的中間體,HPMA可用于鍋爐阻垢劑.
)是合成高分子化合物HPMA的中間體,HPMA可用于鍋爐阻垢劑.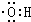 .
.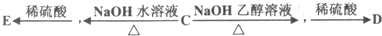
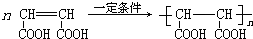 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CO2的電子式: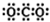 | |
| B. | CS2分子的結構式:S═C═S | |
| C. | S2-的結構示意圖: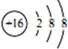 | |
| D. | 8個中子的碳原子的核素符號:${\;}_{8}^{14}$C |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 硫酸與水 | B. | 氯化鈉與水 | C. | 熟石灰與水 | D. | 生石灰與水 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 軌道表示式表示N2中的共用電子對: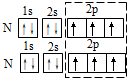 | |
| B. |  只能是氫分子的比例模型 只能是氫分子的比例模型 | |
| C. |  只能是氮分子的球棍模型 只能是氮分子的球棍模型 | |
| D. | CH4分子的比例模型: |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 化學鍵 | Si-Cl | H-H | Si-Si | H-Cl |
| 鍵能(kJ/mol) | 360 | 436 | 176 | 431 |
| A. | 吸收236kJ | B. | 放出236kJ | C. | 放出116kJ | D. | 吸收116kJ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 提純液體混合物常用重結晶法 | |
| B. | 蒸餾時應調整溫度計的水銀球于蒸餾燒瓶支管口附近 | |
| C. | 萃取是利用溶質在兩種互不相溶的溶劑中溶解度的不同,使溶質從一種溶劑內轉移到另一種溶劑的操作 | |
| D. | 常用質譜法進行有機物相對分子質量的測定 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②③⑤ | B. | ①②④⑥ | C. | ①②⑤⑥ | D. | ②③④⑥ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com