
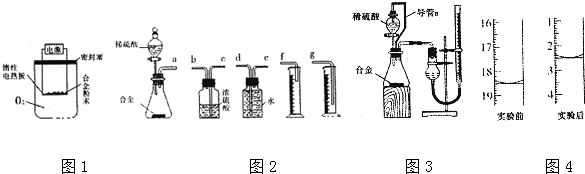
分析 (1)鋁與氫氧化鈉溶液反應生成偏鋁酸鈉與氫氣;
(2)鎂的質量分數最小時,金屬鋁的質量最大,需要的氫氧化鈉溶液最多,實際需要氫氧化鈉溶液的體積應大于或等于最大值,據此計算;
(3)根據反應后為不溶物和溶液兩部分,要得到干燥固體需要的實驗操作解答;
(4)根據Mg、Al都能夠與氧氣化學反應生成氧化物分析還需要知道的數據;
(5)設出金屬鎂和鋁的物質的量,根據合金的質量和灼燒后的質量列式計算出鎂的物質的量,再計算出鎂的質量分數;
(6)根據裝置的組裝順序:合金與酸反應,用排水量氣法測定氫氣的體積,其中盛水的試劑瓶導管一定要短進長出進行排序;
(7)①保持分液漏斗內氣體壓強與錐形瓶內氣體壓強相等,打開分液漏斗活塞時稀硫酸能順利滴下,滴入錐形瓶的稀硫酸體積等于進入分液漏斗的氣體體積,從而消除由于加入稀硫酸引起的氫氣體積誤差;
②滴定管的數值零刻度在上方,兩次的體積之差為測定的氫氣的體積(注意應保持干燥管與滴定管內液面等高),收集氫氣后滴定管內液面上升,讀數減小;
③根據稀硫酸定容錐形瓶能夠將空氣排出分析.
解答 解:(1)鋁與氫氧化鈉溶液反應生成偏鋁酸鈉與氫氣,反應方程式為2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
故答案為:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(2)含鎂為3%時,金屬鋁的含量最高,5.4g合金中鋁的質量為,5.4g×(1-3%)=5.4×97%g,則:
2Al+2NaOH+2H2O=2NaAlO2 +3H2↑
54g 2mol
5.4g×97% V×10-3L×2.0mol/L
所以54g:(5.4g×97%)=2mol:(V×10-3L×2.0mol/L),解得:V=97,故V(NaOH溶液)≥97mL,
故答案為:97;
(3)反應后金屬鋁完全消耗,沒有反應的為金屬鎂,稱量金屬鎂之前需要經過過濾、洗滌、干燥操作,然后再稱量固體質量,從而計算出合金中鎂的含量,
故答案為:過濾、洗滌、干燥固體;
(4)Mg、Al均與氧氣反應,生成金屬氧化物,則還需測定生成物的質量,
故答案為:灼燒后固體的質量;
(5)設xg鋁鎂合金粉末中含有n mol鎂、zmol鋁,則24n+27z=x①,
再根據反應關系式:Mg~MgO、Al~Al2O3,最后得到了yg氧化物,據此列式為:40n+51z=y②,
根據①②解得:z=$\frac{3y-5x}{18}$mol,鋁的質量為:27g/mol×$\frac{3y-5x}{18}$mol=$\frac{9y-15x}{2}$g,合金中鎂的質量分數為:$\frac{x-\frac{9y-15x}{2}}{x}$=$\frac{17x-9y}{2x}$,
故答案為:$\frac{17x-9y}{2x}$;
(6)裝置的組裝順序:合金與酸反應,用排水量氣法測定氫氣的體積,其中盛水的試劑瓶導管一定要短進長出,利用增大壓強原理將水排出,量筒中水的體積就是生成氫氣的體積,量筒內導管應伸入量筒底部,故連接順序為:(a)接(e)(d)接(g),
故答案為:e、d接g;
(7)①裝置中導管a的作用是:保持分液漏斗內氣體壓強與錐形瓶內氣體壓強相等,打開分液漏斗活塞時稀硫酸能順利滴下,滴入錐形瓶的稀硫酸體積等于進入分液漏斗的氣體體積,從而消除由于加入稀硫酸引起的氫氣體積誤差,
故答案為:保持分液漏斗內氣體壓強與錐形瓶內氣體壓強相等,打開分液漏斗活塞時稀硫酸能順利滴下,滴入錐形瓶的稀硫酸體積等于進入分液漏斗的氣體體積,從而消除由于加入稀硫酸引起的氫氣體積誤差;
②滴定管的數值零刻度在上方,兩次的體積之差為測定的氫氣的體積,收集氫氣后滴定管內液面讀數減小,反應前滴定管讀數為18.50mL,反應后滴定管讀數為2.50mL,所以測定氫氣的體積為:18.50mL-2.50mL=16.00mL,
故答案為:16.00mL;
③由于稀硫酸滴入錐形瓶中,即使不生成氫氣,也會將瓶內空氣排出,使所測氫氣體積偏大;實驗結束時,連接廣口瓶和量筒的導管中有少量水存在,使所測氫氣體積偏小,
故答案為:由于稀硫酸滴入錐形瓶中,即使不生成氫氣,也會將瓶內空氣排出,使所測氫氣體積偏大;實驗結束時,連接廣口瓶和量筒的導管中有少量水存在,使所測氫氣體積偏小.
點評 本題考查物質含量的測定、對實驗原理與裝置的理解、實驗方案設計等,難度中等,理解實驗原理是解題的關鍵,是對知識的綜合考查,要求學生具有扎實的基礎及綜合運用知識分析問題、解決問題的能力.


 津橋教育計算小狀元系列答案
津橋教育計算小狀元系列答案科目:高中化學 來源: 題型:選擇題
| A. | ①②⑤ | B. | ①③④ | C. | ②③⑤ | D. | ①③④⑥ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 如圖是Zn和Cu形成的原電池,某實驗小組實驗后,記錄如圖所示,描述合理的是 ( )
如圖是Zn和Cu形成的原電池,某實驗小組實驗后,記錄如圖所示,描述合理的是 ( )| ①Cu為陽極,Zn為陰極 ②Cu極上有氣泡產生 ③SO42-向Cu極移動 ④若有0.5mol電子流經導線,可產生0.25mol氣體 ⑤電子的流向是Cu→導線→Zn ⑥正極反應式:Cu+2e-═Cu2+ |
| A. | ①②③ | B. | ②④ | C. | ④⑤⑥ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2SO3(g)?2SO2(g)+O2(g)△H>0 | B. | N2(g)+3H2(g)?2NH3(g)△H<0 | ||
| C. | 4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H<0 | D. | H2(g)+CO(g)?C(s)+H2O(g)△H>0 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2mol/L | B. | 3mol/L | C. | 4mol/L | D. | 5mol/L |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
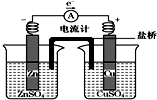
| A. | 鹽橋是浸泡過KCl溶液的瓊脂形成的,其中Cl-移向左池 | |
| B. | 銅片質量逐漸減少 | |
| C. | 電流從銅片經導線流向鋅片 | |
| D. | 銅離子在銅片表面被還原 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常溫常壓下,11.2 L氯氣所含原子數目為NA | |
| B. | 2 L 0.2 mol/L K2SO4溶液SO42-物質的量濃度為0.4 mol/L | |
| C. | 1 mol Na作還原劑可提供電子數為NA | |
| D. | 同溫、同壓下NA個CO2分子和NA個O2分子的體積相同 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 該固體粉末中一定不含有BaCl2 | |
| B. | 該固體粉末中一定含有KNO3 | |
| C. | 它的組成可能是CaCO3、BaCl2、CuSO4 | |
| D. | 它的組成一定是CaCO3、Na2SO4、KNO3 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com