
分析 (1)氯氣與NaOH反應生成氯化鈉、次氯酸鈉和水;
(2)具有強氧化性的物質可替代Cl2為自來水殺菌消毒;
(3)①NaCl屬于離子化合物,含有離子鍵,Cl2中氯原子之間形成共價鍵;
②由題目信息可知,SO2與NaCl等物質生成硫酸鈉和Cl2,根據S、O原子比例關系可知,應有氧氣參與反應,配平書寫化學方程式;
③發生反應:H2O2(l)+Cl2(g)=2HCl(g)+O2(g),
已知:①2H2O2(l)═2H2O(l)+O2(g)△H1=-196.46kJ•mol-1
②H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H2=-285.84kJ•mol-1
③Cl2(g)+H2(g)═2HCl(g)△H3=-184.60kJ•mol-1
根據蓋斯定律,①×$\frac{1}{2}$+③-②可得:H2O2(l)+Cl2(g)=2HCl(g)+O2(g),反應熱也進行相應的計算,進而書寫熱化學方程式;
(4)Ⅰ中電解過程中陽極Cl失去電子.
解答 解:(1)氯氣與氫氧化鈉反應生成氯化鈉、次氯酸與水,反應離子方程式為Cl2+2OH-=ClO-+Cl-+H2O,故答案為:Cl2+2OH-=ClO-+Cl-+H2O;
(2)替代Cl2為自來水殺菌消毒的物質應具有強氧化性,可以用臭氧、ClO2代替,氨氣不能殺菌消毒、硫酸鋁可以除去懸浮物質,不能殺菌消毒,故答案為:ad;
(3)①NaCl屬于離子化合物,含有離子鍵,Cl2中氯原子之間形成共價鍵,故答案為:離子鍵;共價鍵;
②由題目信息可知,SO2與NaCl等物質生成硫酸鈉和Cl2,根據S、O原子比例關系可知,應有氧氣參與反應,反應化學方程式為2NaCl+SO2+O2$\frac{\underline{\;\;△\;\;}}{\;}$Na2SO4+Cl2,
故答案為:2NaCl+SO2+O2$\frac{\underline{\;\;△\;\;}}{\;}$Na2SO4+Cl2;
③發生反應:H2O2(l)+Cl2(g)=2HCl(g)+O2(g),
已知:①2H2O2(l)═2H2O(l)+O2(g)△H1=-196.46kJ•mol-1
②H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H2=-285.84kJ•mol-1
③Cl2(g)+H2(g)═2HCl(g)△H3=-184.60kJ•mol-1
根據蓋斯定律,①×$\frac{1}{2}$+③-②可得:H2O2(l)+Cl2(g)=2HCl(g)+O2(g),△H=(-196.46kJ•mol-1)×$\frac{1}{2}$+(-184.60kJ•mol-1)-(-285.84kJ•mol-1)=+3.01kJ•mol-1,故熱化學方程式為:H2O2(l)+Cl2(g)=2HCl(g)+O2(g)△H=+3.01 kJ/mol,
故答案為:H2O2(l)+Cl2(g)=2HCl(g)+O2(g)△H=+3.01 kJ/mol;
(4)Ⅰ中電解過程中陽極Cl失去電子,陽極反應為Cl--6e-+3H2O═ClO3-+6H+,故答案為:Cl--6e-+3H2O═ClO3-+6H+.
點評 本題考查物質的性質及反應原理,為高頻考點,把握物質的性質、發生的反應、蓋斯定律計算反應熱等為解答的關鍵,側重元素化合物知識及反應原理的綜合考查,題目難度不大.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:填空題
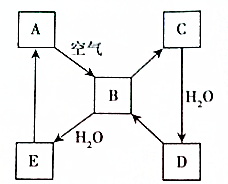 如圖表示某固態單質A及其化合物之間的轉化關系(某些產物和反應條件已略去).化合物B在常溫常壓下為氣體,B和C的相對分子質量之比為4:5,化合物D是重要的工業原料.
如圖表示某固態單質A及其化合物之間的轉化關系(某些產物和反應條件已略去).化合物B在常溫常壓下為氣體,B和C的相對分子質量之比為4:5,化合物D是重要的工業原料.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
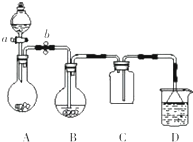 某化學小組設計了如圖所示裝置.用以探究Cu跟濃H2SO4的反應并收集少量氣態產物(加熱及夾持裝置省略).
某化學小組設計了如圖所示裝置.用以探究Cu跟濃H2SO4的反應并收集少量氣態產物(加熱及夾持裝置省略).查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 玻璃棒 | B. | 膠頭滴管 | C. | 托盤天平 | D. | 容量瓶 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 甲醇[CH3OH] | B. | 氯化鈣[CaCl2] | C. | 尿素[CO(NH2)2] | D. | 亞硝酸鈉[NaNO2] |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A.用Ca(OH)2和 NH4Cl制取NH3 | B.從碘水中提取碘單質 | C.從食鹽水中獲取氯化鈉 | D.用自來水制取蒸餾水 |
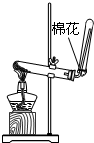 | 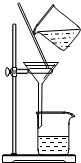 |  |  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2KMnO4+5H2${\;}_{\;}^{18}$O2+3H2SO4→K2SO4+2MnSO4+5${\;}_{\;}^{18}$O2↑+8H2O | |
| B. | NH4Cl+${\;}_{\;}^{2}$H2O?NH3•${\;}_{\;}^{2}$H2O+HCl | |
| C. | K${\;}_{\;}^{37}$ClO3+6HCl→K${\;}_{\;}^{37}$Cl+3Cl2↑+3H2O | |
| D. | 2Na2O2+2H2${\;}_{\;}^{18}$O→4NaOH+${\;}_{\;}^{18}$O2↑ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com