
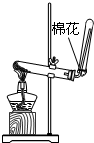
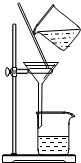
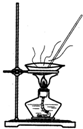
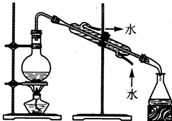
| A.用Ca(OH)2和 NH4Cl制取NH3 | B.從碘水中提取碘單質 | C.從食鹽水中獲取氯化鈉 | D.用自來水制取蒸餾水 |
 |  |  |  |
| A. | A | B. | B | C. | C | D. | D |
分析 A.Ca(OH)2和NH4Cl在加熱條件下可生成NH3,氨氣密度比空氣小;
B.碘易溶于有機溶劑;
C.可用蒸發的方法分離氯化鈉;
D.水易揮發,可用蒸餾的方法制備蒸餾水.
解答 解:A.Ca(OH)2和NH4Cl在加熱條件下可生成NH3,氨氣密度比空氣小,反應生成水,試管口略向下傾斜,故A正確;
B.碘易溶于有機溶劑,應用萃取的方法分離,故B錯誤;
C.水易揮發,可用蒸發的方法分離氯化鈉,故C正確;
D.水易揮發,可用蒸餾的方法制備蒸餾水,故D正確.
故選B.
點評 本題考查較為綜合,涉及物質的分離、制備等基本實驗操作的考查,側重于實驗方案的評價,注意把握物質的性質以及操作要點,題目難度不大.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A.打磨磁石制指南針 | B.燒結粘土制陶瓷 | C.濕法煉銅 | D.鐵的冶煉 |
 |  |  |  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | 鐵的狀態 | 鹽酸的濃度 | 反應的溫度 |
| A | 片狀 | 1 mol/L | 20℃ |
| B | 片狀 | 3 mol/L | 40℃ |
| C | 粉末 | 1 mol/L | 20℃ |
| D | 粉末 | 3 mol/L | 40℃ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
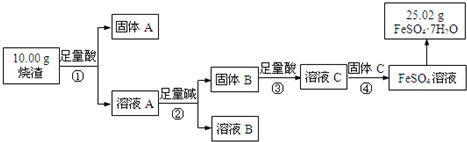
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com