
| A. | ①②③④⑤ | B. | ②③④⑤ | C. | ②③④ | D. | ②③⑤ |
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | “青蒿一握,以水二升漬,絞取汁”,屠呦呦對青蒿素的提取屬于化學變化 | |
| B. | “霾塵積聚難見路人”,霧霾所形成的氣溶膠有丁達爾效應 | |
| C. | “熬膽礬鐵釜,久之亦化為銅”,該過程發生了置換反應 | |
| D. | 維生素C具有還原性,在人體內起抗氧化作用 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
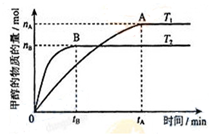 甲醇是重要的化工原料.利用合成氣(主要成分為CO、CO2和H2)在催化劑的作用下
甲醇是重要的化工原料.利用合成氣(主要成分為CO、CO2和H2)在催化劑的作用下 .
.查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 如圖所示.
如圖所示.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
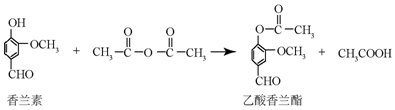
| A. | 乙酸香蘭酯的分子式為C18H8O4 | |
| B. | FeCl3溶液可用于區別香蘭素與乙酸香蘭酯 | |
| C. | 1mol乙酸香蘭酯最多可以與5molH2發生加成反應 | |
| D. | 乙酸香蘭脂在足量NaOH溶液中水解得到乙酸和香蘭素 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
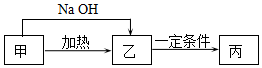 甲、乙、丙3種物質在生產生活中用途廣泛,它們均是由短周期元素組成的化合物.甲含有4種元素,其中一種元素原子的最外層電子數是內層的2倍.
甲、乙、丙3種物質在生產生活中用途廣泛,它們均是由短周期元素組成的化合物.甲含有4種元素,其中一種元素原子的最外層電子數是內層的2倍.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com