
 甲醇是重要的化工原料.利用合成氣(主要成分為CO、CO2和H2)在催化劑的作用下
甲醇是重要的化工原料.利用合成氣(主要成分為CO、CO2和H2)在催化劑的作用下 .
.分析 (1)二氧化碳中C原子和O原子間為雙鍵,CO2是共價化合物,其結構式為O=C=O,碳原子和氧原子之間有2對電子;
(2)由蓋斯定律可知,將②-①可得反應③,反應前后氣體體積減小,則反應熵變小于0;
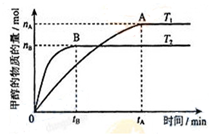
(3)結合圖象中甲醇的變化來計算反應速率,并利用圖象中時間與速率的關系來分析T1、T2,再利用影響平衡的因素來分析解答;
(4)化學平衡的三段法計算平衡時各物質的物質的量,再利用反應前后氣體的物質的量之比等于壓強之比來解答;K=$\frac{生成物平衡濃度冪次方乘積}{反應物平衡濃度冪次方乘積}$;
解答 解:(1)二氧化碳中C原子和O原子間為雙鍵,CO2是共價化合物,其結構式為O=C=O,碳原子和氧原子之間有2對電子,其電子式為 ,
,
故答案為: ;
;
(2)已知反應:①CO(g)+2H2(g)═CH3OH(g)△H1=-99kJ.mol-1,
②CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H2=-58kJ.mol-1
根據蓋斯定律可知,將②-①可得反應③,故△H3=(-58kJ.mol-1)-(-99kJ.mol-1)=+41KJ/mol,
①反應正向是氣體體積減小的反應,反應的熵變△S<0,
故答案為:+41;<;
(3)根據題給圖象分析可知,T2先達到平衡則T2>T1,由溫度升高反應速率增大可知T2的反應速率大于T1,又溫度高時平衡狀態CH3OH的物質的量少,CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H2=-58kJ/mol,反應為放熱反應,則升溫說明可逆反應CO2+3H2?CH3OH+H2O向逆反應方向移動,
①v(CH3OH)=$\frac{\frac{{n}_{A}}{2l}}{{t}_{A}}$=$\frac{{n}_{A}}{2{t}_{A}}$mol/L•min,故①錯誤;
②當v(CH3OH)=v(H2O)時,不能證明反應正逆反應速率相同,不能說明反應達到平衡,故②錯誤;
③混合氣體質量不變,B點溫度越高平衡逆向進行,氣體物質的量增大,則氣體的平均相對分子質量A點大于B點,故③正確;
④處于A點的反應體系從T1變到T2,升高溫度,平衡向逆反應方向移動,達到平衡時,氫氣物質的量增大、甲醇的物質的量減小,故$\frac{n({H}_{2})}{n(C{H}_{3}OH)}$增大,故④正確;
故答案為:③④;
(4)由化學平衡的三段模式法計算可知,容器體積為2L,
CO2(g)+3H2(g)=CH3OH(g)+H2O(g)
起始(mol/L) 1 3 0 0
變化(mol/L) 1×50% 1.5 0.5 0.5
平衡(mol/L) 0.5 1.5 0.5 0.5
根據相同條件下氣體的壓強之比等于物質的量之比,
則容器內的壓強與起始壓強之比=$\frac{0.5+1.5+0.5+0.5}{1+3}$=$\frac{3}{4}$,
平衡常數K=$\frac{0.5×0.5}{0.5×1.{5}^{3}}$=$\frac{4}{27}$=0.15
故答案為:$\frac{3}{4}$;0.15;
點評 本題綜合性較強,考查知識點較多,注重了對高考熱點的考查,學生應熟悉蓋斯定律、熱化學反應方程式、反應速率、化學平衡、原電池、圖象分析判斷等重要知識來解答,題目難度中等.


 星級口算天天練系列答案
星級口算天天練系列答案科目:高中化學 來源: 題型:實驗題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | FeSO4溶液中滴加NaOH濃液 | B. | 碳酸氫鈉溶液中滴加稀鹽酸溶液 | ||
| C. | 硫酸鐵溶液中滴加硫氰化鉀溶液 | D. | 氯化鐵溶液中加入還原性鐵粉 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
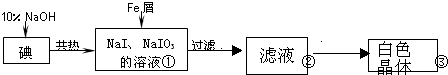
| 實驗方案 | 實驗現象 | 結論 |
| 將白色晶體溶于水,并滴2滴淀粉溶液 | 得到無色溶液 | / |
| 取少量溶液液于試管A中,加入足量的1mol/LH2SO4. | 溶液顯藍色 | 溶液中含IO3- |
| 另取少量溶液液于試管B中,滴入幾滴酚酞溶液. | 溶液變紅. | 溶液中含大量0H- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②③④⑤ | B. | ②③④⑤ | C. | ②③④ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| HA | H2B | HC | ||
| Ka | Ka1 | Ka2 | Ka3 | Ka4 |
| 數值 | ||||
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 實驗目的 | 實驗方法 | |
| A. | 從食鹽水中獲得食鹽 | 過濾 |
| B. | 將海水淡化為可飲用水 | 蒸發 |
| C. | 分離水和碘的四氯化碳溶液 | 分液 |
| D. | 分離碳酸鈉溶液和乙酸乙酯 | 萃取 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com