
分析 I(1)到達平衡后,生成amolC,由反應可知,轉化的A為amol;
(2)到達平衡后,A和C的物質的量分別是ymol和3amol,由物質的量與壓強成正比可知,極性轉化后A、B的起始量相同;
(3)若在(2)的平衡混合物中再加入3molC,與上述平衡為等效平衡,物質的量分數不變;
II(4)開始時放入1molA和1molB到達平衡后生成bmolC,體積不變時,發生反應氣體的物質的量減小,壓強減小,則平衡逆向移動.
解答 解:(1)到達平衡后,生成amolC,則
A(氣)+B(氣)?C(氣)
起始量(mol) 1 1 0
變化量(mol) a a a
平衡量(mol) 1-a 1-a a
A的物質的量為(1-a)mol,
故答案為:(1-a);
(2)恒溫、恒壓下到達平衡后,C的物質的量為3amol,說明和(2)所達到的平衡是相同的平衡,滿足A、B起始量分為3mol、3mol,假設反應正向進行,則
A(氣)+B(氣)?C(氣)
起始量(mol) x 2 1
變化量(mol) 3a-1 3a-1 3a-1
平衡量 (mol) y 3-3a 3a
依據等效平衡,y=3-3a,x=2,
故答案為:2;3-3a;
(3)若在(2)的平衡混合物中再加入3molC,與上述平衡為等效平衡,物質的量分數不變,則再次到達平衡后,C的物質的量分數是$\frac{a}{1-a+1-a+a}$=$\frac{a}{2-a}$,
故答案為:$\frac{a}{2-a}$;
II(4)開始時放入1molA和1molB到達平衡后生成bmolC,體積不變時,發生反應氣體的物質的量減小,壓強減小,則平衡逆向移動,則b小于a,
故答案為:(乙).
點評 本題考查化學平衡的計算,為高頻考點,把握化學平衡三段法、等效平衡及平衡移動為解答的關鍵,側重分析與計算能力的考查,注意等效平衡的判斷,題目難度不大.


 優學名師名題系列答案
優學名師名題系列答案科目:高中化學 來源: 題型:選擇題
| A. | c1=2c2 | B. | c2=2cl | C. | c2>2c1 | D. | c2<2cl |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
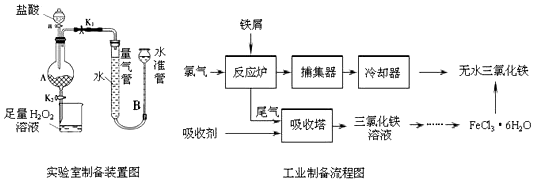
| 溫度/℃ | 0 | 20 | 80 | 100 |
| 溶解度(g/100 g H2O) | 74.4 | 91.8 | 525.8 | 535.7 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
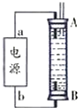 碳和碳的化合物在生產、生活中的應用非常廣泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一種理想,更是一種值得期待的新的生活方式.
碳和碳的化合物在生產、生活中的應用非常廣泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一種理想,更是一種值得期待的新的生活方式.| 實驗組 | 溫度/℃ | 起始量/mol | 平衡量/mol | 達到平衡所需時間/min | CO2 |
| H2O | CO | ||||
| 1 | 650 | 4 | 1.6 | 1.6 | 5 |
| 2 | 900 | 2 | 0.4 | 0.4 | 3 |
| 3 | 900 | 2 | 0.4 | 0.4 | 1 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
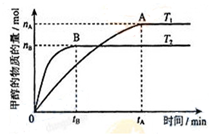 甲醇是重要的化工原料.利用合成氣(主要成分為CO、CO2和H2)在催化劑的作用下
甲醇是重要的化工原料.利用合成氣(主要成分為CO、CO2和H2)在催化劑的作用下 .
.查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
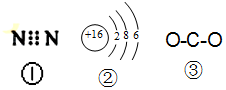
| A. | 圖中的①是N2的電子式 | |
| B. | 圖中的②是S2-的結構示意圖 | |
| C. | 質子數為53,中子數為78的碘原子:13153I | |
| D. | 圖 ③為CO2的結構式 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 碳酸鈣的狀態 | 鹽酸的濃度 | 反應的溫度 | |
| A. | 塊狀 | 1 mol/L | 25℃ |
| B. | 塊狀 | 6 mol/L | 40℃ |
| C. | 粉末 | 1 mol/L | 25℃ |
| D. | 粉末 | 6 mol/L | 40℃ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com