
①已達平衡的反應C(s)+H2O(g) CO(g)+H2(g),當增加反應物物質的量時,平衡一定向正反應方向移動
CO(g)+H2(g),當增加反應物物質的量時,平衡一定向正反應方向移動
②已達平衡的反應N2(g)+3H2(g) 2NH3(g),當增大N2的濃度時,平衡向正反應方向移動,N2的轉化率一定增大
2NH3(g),當增大N2的濃度時,平衡向正反應方向移動,N2的轉化率一定增大
③有氣體參加的反應平衡時,若減小反應器容積時,平衡一定向氣體體積增大的方向移動
④有氣體參加的反應達平衡時,在恒壓反應器中充入稀有氣體,平衡一定不移動
A. ①④ B. ①②③
C. ②③④ D. ①②③④
科目:高中化學 來源:2017屆浙江省高三3月選考化學試卷(解析版) 題型:選擇題
某工廠的污水中可能含有NH4+、Fe2+、Cl-、Fe3+、SO42-、HCO3-離子中的一種或幾種,為檢驗上述離子,某興趣小組設計了如下實驗方案,請回答下列問題:
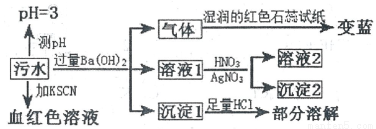
下列說法正確的是
A. 該污水中一定存在Fe3+,不存在Fe2+ B. 沉淀l為BaCO3和BaSO4
C. 沉淀2可能為AgCl和Ag2SO4 D. 該污水中一定存在NH4+、Cl-、Fe3+、SO42-離子
查看答案和解析>>
科目:高中化學 來源:2016-2017學年黑龍江省高一下學期開學考試化學試卷(解析版) 題型:選擇題
下列類比關系正確的是( )
A. Al與濃鹽酸反應放出H2,則與濃硫酸反應也放出H2
B. Al與Fe2O3能發生鋁熱反應,則與MnO2也能發生鋁熱反應
C. Fe與Cl2反應生成FeCl3,則與I2反應可生成FeI3
D. Na2O2與CO2反應生成Na2CO3和O2,則與SO2反應可生成Na2SO3和O2
查看答案和解析>>
科目:高中化學 來源:2016-2017學年新疆哈密地區第二中學高二上學期期末考試化學試卷(解析版) 題型:選擇題
在25 ℃時,密閉容器中X、Y、Z三種氣體的初始濃度和平衡濃度如下表:
物質 | X | Y | Z |
初始濃度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡濃度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列說法錯誤的是( )
A. 反應達到平衡時,X的轉化率為50%
B. 反應可表示為X+3Y  2Z,其平衡常數為1 600(mol/L) -2
2Z,其平衡常數為1 600(mol/L) -2
C. 增大壓強使平衡向生成Z的方向移動,平衡常數增大
D. 改變溫度可以改變此反應的平衡常數
查看答案和解析>>
科目:高中化學 來源:2016-2017學年新疆哈密地區第二中學高二上學期期末考試化學試卷(解析版) 題型:選擇題
把下列溶液加水稀釋,溶液中每種離子的濃度都不會增加的是( )
A. CH3COOH溶液 B. NaCl溶液 C. NaOH溶液 D. FeCl3溶液
查看答案和解析>>
科目:高中化學 來源:2016-2017學年新疆哈密地區第二中學高二上學期期末考試化學試卷(解析版) 題型:選擇題
下列物質的水溶液能導電,但屬于非電解質的是( )
A. CH3COOH B. SO2 C. (NH4)2CO3 D. Cl2
查看答案和解析>>
科目:高中化學 來源:遼寧省大連市2017屆高三3月雙基測試化學試卷 題型:選擇題
下表是25℃時某些鹽的溶度積常數和弱酸的電離平衡常數,下列說法正確的是
化學式 | AgCl | Ag2CrO4 | CH3COOH | HClO | H2CO3 |
Ksp或Ka | Ksp=1.8×10-10 | Ksp=2×10-12 | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
A. 相同濃度CH3COONa和NaClO的混合液中,各離子濃度的大小關系是c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
B. 向0.1mol·L-1CH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=9 :5,此時溶液pH=5
C. 碳酸鈉溶液中滴加少量氯水的離子方程式是2CO32-+Cl2+H2O=2HCO3-+Cl-+ClO-
D. 向濃度均為1×10-3mol·L-1的KCl和K2CrO4混合液中滴加1×10-3mol·L-1的AgNO3溶液,CrO42-先形成沉淀
查看答案和解析>>
科目:高中化學 來源:遼寧省大連市2017屆高三3月雙基測試化學試卷 題型:選擇題
下列關于有機化合物的說法正確的是
A. 聚氯乙烯分子中含有碳碳雙鍵
B. 油脂的皂化反應屬于加成反應
C. 糖類物質均可直接食用并能被人體吸收
D. 以淀粉為原料可制取乙酸乙酯
查看答案和解析>>
科目:高中化學 來源:2016-2017學年湖南省長沙市高二上學期期末考試化學試卷(解析版) 題型:填空題
(1)肼(N2H4)是火箭推進器中常用的高能燃料,已知0.4 mol液態肼和足量H2O2反應,生成N2和水蒸氣,放出256. 65kJ的熱量,請寫出該反應的熱化學方程式:__________。
(2)工業上制氫氣的一個重要反應是:CO(g) +H2O(g)=CO2(g)+H2(g)
已知在25℃時:C(石墨)+ O2(g)=CO(g) △H1=-111kJ·mol-1
O2(g)=CO(g) △H1=-111kJ·mol-1
H2(g)+ O2(g)=H2O(g) △H2=-242 kJ·mol-1
O2(g)=H2O(g) △H2=-242 kJ·mol-1
C(石墨)+O2(g)=CO2(g) △H3=-394kJ·mol-1
試計算25℃時一氧化碳與水作用轉化為氫氣和二氧化碳反應的反應熱△H=______kJ·mol-1
(3)CO2再在自然界循環時可與CaCO3反應,CaCO3是一種難溶物質,其Ksp=2.8×10-9。CaCl2溶液與NaCO3溶液混合可形成CaCO3沉淀,現將等體積的CaCl2溶液與Na2CO3溶液混合,若Na2CO3溶液的濃度為2×10-4mol / L ,則生成沉淀所需CaCl2溶液的最小濃度為__________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com