
下列關于有機化合物的說法正確的是
A. 聚氯乙烯分子中含有碳碳雙鍵
B. 油脂的皂化反應屬于加成反應
C. 糖類物質均可直接食用并能被人體吸收
D. 以淀粉為原料可制取乙酸乙酯
 全能測控一本好卷系列答案
全能測控一本好卷系列答案科目:高中化學 來源:2016-2017學年黑龍江省高一下學期開學考試化學試卷(解析版) 題型:選擇題
現有CuO和Fe3O4的混合物7.2g,向其中加入1mol·L-1的H2SO4溶液150mL恰好完全反應,若將14.4 g該混合物用足量CO還原,充分反應后剩余固體質量為( )
A. 3.2g B. 4.8g C. 6g D. 9.6g
查看答案和解析>>
科目:高中化學 來源:2016-2017學年新疆哈密地區第二中學高二上學期期末考試化學試卷(解析版) 題型:選擇題
①已達平衡的反應C(s)+H2O(g) CO(g)+H2(g),當增加反應物物質的量時,平衡一定向正反應方向移動
CO(g)+H2(g),當增加反應物物質的量時,平衡一定向正反應方向移動
②已達平衡的反應N2(g)+3H2(g) 2NH3(g),當增大N2的濃度時,平衡向正反應方向移動,N2的轉化率一定增大
2NH3(g),當增大N2的濃度時,平衡向正反應方向移動,N2的轉化率一定增大
③有氣體參加的反應平衡時,若減小反應器容積時,平衡一定向氣體體積增大的方向移動
④有氣體參加的反應達平衡時,在恒壓反應器中充入稀有氣體,平衡一定不移動
A. ①④ B. ①②③
C. ②③④ D. ①②③④
查看答案和解析>>
科目:高中化學 來源:遼寧省大連市2017屆高三3月雙基測試化學試卷 題型:選擇題
下表給出了X、Y、Z、W四種短周期主族元素的部分信息。請根據這些信息判斷下列說法中正確的是
元素 | X | Y | Z | W |
原子半徑 | 0.102 | 0.16 | 0.074 | 0.071 |
最高正價或最低負價 | +6 | +2 | -2 | -1 |
A. HW是熱穩定性最強的氫化物
B. Z的最高正價為+6
C. 原子序數X>Y>Z>W
D. 純凈的X單質與純凈的Z單質反應生成XZ3
查看答案和解析>>
科目:高中化學 來源:遼寧省大連市2017屆高三3月雙基測試化學試卷 題型:選擇題
根據表中信息判斷,下列選項不正確的是
序號 | 反應物 | 產物 |
① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4 |
② | Cl2、FeBr2 | FeCl3、FeBr3 |
③ | MnO4-、Cl- | Cl2、Mn2+ |
A. 第①組反應的其余產物為H2O和O2
B. 第②組反應中參加反應的Cl2與FeBr2的物質的量之比為1:2
C. 第③組反應中生成1molCl2,轉移電子2mol
D. 氧化性由強到弱順序為MnO4->Cl2>Fe3+>Br2
查看答案和解析>>
科目:高中化學 來源:2017屆重慶市高三下學期第一次月考理科綜合化學試卷(解析版) 題型:填空題
甲醇是重要的化學工業基礎原料和清潔液體燃料。工業上可利用CO或CO2來生產燃料甲醇。已知甲醇制備的有關化學反應以及在不同溫度下的化學反應平衡常數如下表所示:
化學反應 | 平衡常數 | 溫度℃ | |
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 2.50 |
③3H2(g)+CO2(g) | K3 | ||
(1)反應②是________________(填“吸熱”或“放熱”)反應。
(2)某溫度下反應①中H2的平衡轉化率(a)與體系總壓強(P)的關系,如左下圖所示。則平衡狀態由A變到B時,平衡常數K(A)_____________K(B)(填“>”、“<”或“=”)。據反應①與②可推導出K1、K2與K3之間的關系,則K3=_______(用K1、K2表示)。
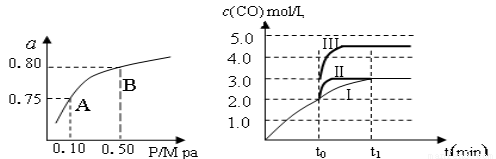
(3)在3 L容積可變的密閉容器中發生反應②,已知c(CO)與反應時間t變化曲線Ⅰ如右上圖所示,若在t0時刻分別改變一個條件,曲線Ⅰ變為曲線Ⅱ和曲線Ⅲ。
當曲線Ⅰ變為曲線Ⅱ時,改變的條件是_____________________。
當曲線Ⅰ變為曲線Ⅲ時,改變的條件是_____________________。
(4)一種甲醇燃料電池,使用的電解質溶液是2mol·L-1的KOH溶液。
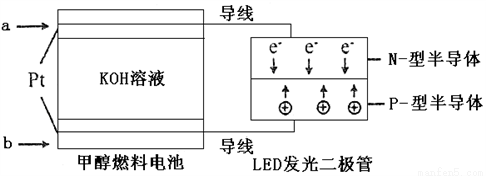
請寫出加入(通入)b物質一極的電極反應式_________________;
每消耗6.4g甲醇轉移的電子數為_______________。
(5)一定條件下甲醇與一氧化碳反應可以合成乙酸。通常狀況下,將a mol/L的醋酸與b mol/LBa(OH)2溶液等體積混合后,溶液中:2c(Ba2+)= c(CH3COO-),用含a和b的代數式表示該混合溶液中醋酸的電離常數Ka為________________。
查看答案和解析>>
科目:高中化學 來源:2017屆重慶市高三下學期第一次月考理科綜合化學試卷(解析版) 題型:選擇題
設NA為阿伏伽德羅常數的值,下列說法正確的是
A. 1.0L1.0mol·L-1的NaAlO2溶液中含有的氧原子數為2NA
B. 2.4g鎂在空氣中完全燃燒生成MgO和Mg3N2,轉移的電子數為0.2NA
C. 標準狀況下,3.36LC2H4和C3H6的混合氣體中含有碳碳雙鍵的數目為0.15 NA
D. 用生氫劑CaH2與水反應制氫時,生成1molH2時轉移電子數目為2 NA
查看答案和解析>>
科目:高中化學 來源:2017屆河北省唐山市高三下學期第一次模擬考試理綜化學試卷(解析版) 題型:簡答題
下圖表示從廢舊普通鋅錳電池內容物中回收制備KMnO4等物質的一種工藝(不考慮廢舊電池中實際存在的少量其他金屬)。
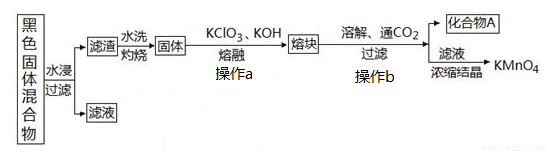
(1)KMnO4稀溶液是一種常用消毒劑,其消毒機理與下列物質相似的是______________(填序號)
A.雙氧水 B.75%酒精 C.苯酚 D.84消毒液(NaClO溶液)
(2)①黑色固體混合物水浸時為提高浸出速率,常采用的措施為_________________(答出兩條即可)。
②濾渣水洗灼燒后固體是一種黑色的化合物,操作a中得到熔塊的主要成分是K2MnO4和KCl,該過程中發生反應的化學方程式為:_____________________________。
③圖中產物A是一種難溶于水的黑色固體,其化學式為:_________________。
(3)測定KMnO4產品的純度可用標準Na2S2O3溶液進行滴定。
①配制250 mL 0.100 0 mol·L-1標準Na2S2O3溶液,需要使用的玻璃儀器有燒杯、膠頭滴管、量筒和______、_______;
②取上述制得的KMnO4產品0.700 0 g,酸化后用0.100 0 mol·L-1標準Na2S2O3溶液進行滴定,滴定至終點記錄實驗消耗Na2S2O3溶液的體積,重復步驟②,三次平行實驗數據如下表。
實驗次數 | 1 | 2 | 3 |
消耗Na2S2O3溶液體積/mL | 19.30 | 20.98 | 21.02 |
(有關離子方程式為:MnO4-+S2O32-+H+—SO42-+Mn2++H2O,未配平)
將0.100 0 mol·L-1標準Na2S2O3溶液盛裝在________(填“酸式”或“堿式”)滴定管中進行滴定。計算該KMnO4產品的純度_________________。
查看答案和解析>>
科目:高中化學 來源:廣東省2016-2017學年高一上學期期末考試化學試卷 題型:選擇題
氮化鋁廣泛應用于電子陶瓷等工業領域.在一定條件下,AlN可通過反應:Al2O3+N2+3C 2AlN+3CO合成.下列敘述正確的是( )
2AlN+3CO合成.下列敘述正確的是( )
A. AlN的摩爾質量為41g
B. AlN中氮的化合價為+3
C. 每生成1mol AlN轉移3mol電子
D. 反應中N2是還原劑
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com