
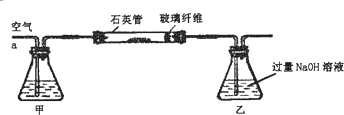
分析 (1)為防止最后乙溶液中混有BaCO3沉淀而影響實驗結果,應將空氣中的二氧化碳除去,所以甲裝置中可用NaOH溶液,過量NaOH溶液與SO2反應生成SO32-和H2O,亞硫酸根離子能被氧氣氧化生成硫酸根離子;
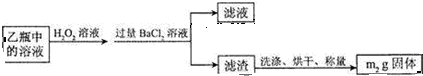
(2)過氧化氫具有強氧化性,將亞硫酸根離子氧化為硫酸根,同時生成水;
(3)最終得到的沉淀為硫酸鋇,根據硫原子守恒計算硫鐵礦中硫的質量,從而計算其質量分數;
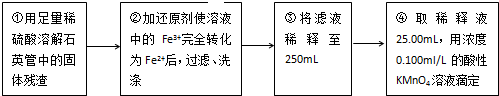
(4)配制250ml一定物質的量濃度的溶液需要燒杯、玻璃棒、膠頭滴管、量筒、250ml容量瓶等儀器;
(5)最后一滴高錳酸鉀溶液滴入時,溶液顏色突變為紫色,且在30s內不變色,說明滴定到達終點;
(6)令硫鐵礦中鐵元素的質量分數為a,根據關系式MnO4-~5Fe2+~5Fe計算硫鐵礦中鐵元素的質量分數.
解答 解:(1)為防止最后乙溶液中混有BaCO3沉淀而影響實驗結果,應將空氣中的二氧化碳除去,所以甲裝置中可用NaOH溶液,過量NaOH溶液與SO2反應生成SO32-和H2O,亞硫酸根離子能被氧氣氧化生成硫酸根離子,乙中反應離子方程式為SO2+2OH-=SO32-+H2O\2SO32-+O2=2SO42-,
故答案為:NaOH;SO2+2OH-=SO32-+H2O、2SO32-+O2=2SO42-;
(2)過氧化氫具有強氧化性,將亞硫酸根離子氧化為硫酸根,同時生成水,反應離子方程式為:SO32-+H2O2═SO42-+H2O,
故答案為:SO32-+H2O2═SO42-+H2O;
(3)根據硫元素守恒,m1gFeS2中的硫元素最終全部生成BaSO4,則有n(BaSO4)=$\frac{m{\;}_{2}}{233}$mol,所以n(S)=$\frac{m{\;}_{2}}{233}$mol,所以黃鐵礦中硫元素的質量分數為:$\frac{\frac{{m}_{2}}{233}mol×32g/mol}{m{\;}_{1}}$×100%=$\frac{32m{\;}_{2}}{233m{\;}_{1}}$×100%,
故答案為:$\frac{32m{\;}_{2}}{233m{\;}_{1}}$×100%;
(4)Ⅲ的步驟③中,一定物質的量濃度溶液的配制中,除了燒杯、玻璃棒、膠頭滴管外,還需要250mL容量瓶,
故答案為:250mL容量瓶;
(5)最后一滴高錳酸鉀溶液滴入時,溶液顏色突變為紫色,且在30s內不變色,說明滴定到達終點,
故答案為:最后一滴高錳酸鉀溶液滴入時,溶液顏色突變為紫色,且在30s內不變色;
(6)令硫鐵礦中鐵元素的質量分數為a,則:
MnO4-~5Fe2+~5Fe
1mol 5×56g
0.1mol/L×25×10-3L×10 m1a g
所以1mol:0.1mol/L×25×10-3L×10=5×56g:m1a g
解得a=$\frac{7}{m{\;}_{1}}$,
故答案為:$\frac{7}{m{\;}_{1}}$.
點評 本題考查物質成分和含量的測定,涉及常用化學用語、溶液的配制、氧化還原滴定、化學計算等,具有較強的綜合性,計算時注意從質量守恒與關系式的角度分析.


 永乾教育寒假作業快樂假期延邊人民出版社系列答案
永乾教育寒假作業快樂假期延邊人民出版社系列答案科目:高中化學 來源: 題型:選擇題
| A. | $\frac{m}{a}L$ | B. | $\frac{2m}{3a}L$ | C. | $\frac{m+n}{a}L$ | D. | $\frac{2(m+n)}{3a}L$ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CuSO4•3H2O | B. | CuSO4•2H2O | C. | CuSO4•H2O | D. | CuSO4 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CH3COOH+CH3CH2OH $?_{△}^{濃硫酸}$CH3COOCH2CH33+H2O | |
| B. | CH2═CH2+HBr→CH3CH2Br | |
| C. | CH4+Cl2$\stackrel{光}{→}$CH3Cl+HCl | |
| D. | 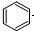 +Br2$\stackrel{FeBr_{3}}{→}$ +Br2$\stackrel{FeBr_{3}}{→}$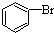 +HBr +HBr |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | H2SO4和NaHSO4都屬于酸 | B. | 火堿和純堿都屬于堿 | ||
| C. | KOH和NH3•H2O都屬于電解質 | D. | Na2O和Na2O2都屬于堿性氧化物 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 9:4 | B. | 6:1 | C. | 7:6 | D. | 11:6 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com