
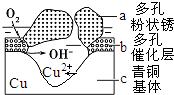 我國古代青銅器工藝精湛,有很高的藝術價值和歷史價值.但出土的青銅器大多受到環境腐蝕,故對其進行修復和防護具有重要意義.
我國古代青銅器工藝精湛,有很高的藝術價值和歷史價值.但出土的青銅器大多受到環境腐蝕,故對其進行修復和防護具有重要意義.分析 (1)核外電子排布式為1s22s22p63s23p63d104s1,由此判斷位置;
(2)A.催化劑降低了反應的活化能,增大活化分子百分數;
B.催化劑降低了反應的活化能,增大活化分子百分數,增大活化分子之間的碰撞機會;
C.催化劑改變反應路徑,但焓變不變;
D.平衡常數只與溫度有關;
(3)Ag2O與有害組分CuCl發生復分解反應,則二者相互交換成分生成另外的兩種化合物;
(4)①根據圖知,氧氣得電子生成氫氧根離子、Cu失電子生成銅離子,發生吸氧腐蝕,則Cu作負極;
②Cl-擴散到孔口,并與正極反應產物和負極反應產物作用生成多孔粉狀銹Cu2(OH)3Cl,負極上生成銅離子、正極上生成氫氧根離子,所以該離子反應為氯離子、銅離子和氫氧根離子反應生成Cu2(OH)3Cl沉淀.
解答 解:(1)原子核外電子層數與其周期數相等,核外電子排布式為1s22s22p63s23p63d104s1,位于元素周期表的第4周期ⅠB族,故答案為:第四周期ⅠB族;
(2)A.催化劑降低了反應的活化能,增大活化分子百分數,故A正確;
B.催化劑降低了反應的活化能,增大活化分子百分數,增大活化分子之間的碰撞機會,所以反應速率增大,故B正確;
C.催化劑改變反應路徑,但焓變不變,故C錯誤;
D.平衡常數只與溫度有關,溫度不變,平衡常數不變,與催化劑無關,故D錯誤;
故選AB;
(3)Ag2O與有害組分CuCl發生復分解反應,則二者相互交換成分生成另外的兩種化合物,反應方程式為Ag2O+2CuCl=2AgCl+Cu2O,
故答案為:Ag2O+2CuCl=2AgCl+Cu2O;
(4)①根據圖知,氧氣得電子生成氫氧根離子、Cu失電子生成銅離子,發生吸氧腐蝕,則Cu作負極,即c是負極,故答案為:c;
②Cl-擴散到孔口,并與正極反應產物和負極反應產物作用生成多孔粉狀銹Cu2(OH)3Cl,負極上生成銅離子、正極上生成氫氧根離子,所以該離子反應為氯離子、銅離子和氫氧根離子反應生成Cu2(OH)3Cl沉淀,離子方程式為2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓,
故答案為:2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓.
點評 本題考查Cu及其化合物的性質,為高頻考點,把握電子排布、化學反應速率及平衡、電化學反應原理等為解答的關鍵,側重分析與應用能力的考查,題目難度不大.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:解答題
| 實驗順序 | 實驗內容 | 實驗現象 |
| ① | A+B | 生成白色沉淀 |
| ② | A+C | 放出無色氣體 |
| ③ | A+D | 放出無色氣體 |
| ④ | B+C | 無明顯變化 |
| ⑤ | B+D | 生成白色沉淀 |
| ⑥ | C+D | 無明顯變化 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
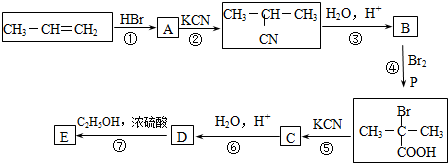

 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 制備Al(OH)3懸濁液:向1mol•L-1AlCl3溶液中加過量的6mol•L-1NaOH溶液 | |
| B. | 提純含有少量乙酸的乙酸乙酯:向含有少量乙酸的乙酸乙酯中加入過量飽和碳酸鈉溶液,振蕩后靜置分液,并除去有機相的水 | |
| C. | 檢驗溶液中是否含有Fe3+:取少量待檢驗溶液,向其中加入少量新制氯水,再滴加KSCN溶液,觀察實驗現象 | |
| D. | 探究催化劑對H2O2分解速率的影響:在相同條件下,向一試管中加入2mL5%H2O2和1mLH2O,向另一試管中加入2mL 10%H2O2和1mLFeCl3溶液,觀察并比較實驗現象 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 能源是人類生活和社會發展的基礎,研究化學反應中的能量變化,有助于更好地利用化學反應為生產和生活服務.閱讀下列有關能源的材料,回答有關問題:
能源是人類生活和社會發展的基礎,研究化學反應中的能量變化,有助于更好地利用化學反應為生產和生活服務.閱讀下列有關能源的材料,回答有關問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 從左向右數第六縱行是ⅥA族 | B. | 七個周期18個族 | ||
| C. | ⅠA族全部是金屬元素 | D. | 所含元素種類最多的族是ⅢB族 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 充入氮氣 | B. | 減小壓強,擴大容器體積 | ||
| C. | 加入催化劑 | D. | 適當升高溫度 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Na2CO3 | B. | NaHCO3 | C. | Na2CO3 和NaHCO3 | D. | NaOH和Na2CO3 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com