
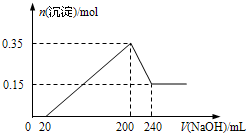
 將一定質量的Mg和Al的混合物投入500mL稀硫酸中,固體全部溶解并產生氣體.待反應完全后,向所得溶液中加入NaOH溶液,生成沉淀的物質的量與加入NaOH溶液的體積關系如圖所示.則下列說法正確的是( )
將一定質量的Mg和Al的混合物投入500mL稀硫酸中,固體全部溶解并產生氣體.待反應完全后,向所得溶液中加入NaOH溶液,生成沉淀的物質的量與加入NaOH溶液的體積關系如圖所示.則下列說法正確的是( )| A. | Mg和Al的總質量為8 g | |
| B. | 硫酸的物質的量濃度為5 mol/L | |
| C. | NaOH溶液的物質的量濃度為5 mol/L | |
| D. | 生成的H2在標準狀況下的體積為11.2 L |
分析 結合圖可知,0~20mL發生酸堿中和,20~200mL發生離子與堿生成沉淀的反應,200~240mL發生氫氧化鋁溶解:Al(OH)3+NaOH=NaAlO2+2H2O,最后剩余的沉淀為氫氧化鎂;加入200mLNaOH溶液時生成沉淀最多,溶液中的溶質為硫酸鈉,
A、根據圖象判斷氫氧化鋁、氫氧化鎂的物質的量,再根據質量守恒定律計算出混合金屬的質量;
B、根據溶解氫氧化鋁消耗的氫氧化鈉的物質的量及氫氧化鈉溶液體積計算出氫氧化鈉溶液濃度,再根據200mL時溶質為硫酸鈉計算出硫酸的濃度物質的量,然后根據c=$\frac{n}{V}$計算出硫酸的濃度;
C、根據(2)的計算可知氫氧化鈉溶液的濃度;
D、與硫酸反應生成的氫氣的體積應為(0.15mol+0.3mol)×22.4 L•mol-1=10.08L.
解答 解:根據圖可知,0~20mL發生酸堿中和,20~200mL發生離子與堿生成沉淀的反應,200~240mL發生Al(OH)3+NaOH=NaAlO2+2H2O,200mL時生成沉淀最多,溶液中的溶質為硫酸鈉,
A、由圖象可知,氫氧化鎂的物質的量為0.15mol,則n(Mg)=n[Mg(OH)2]=0.15mol,溶解的氫氧化鋁的物質的量為:0.35mol-0.15mol=0.2mol,根據鋁原子守恒可得:n(Al)=0.2mol,則Mg和Al的總質量為:0.15mol×24g/mol+0.2mol×27g/mol=9g,故A錯誤;
B、由200~240mL發生反應:Al(OH)3+NaOH=NaAlO2+2H2O,消耗氫氧化鈉的物質的量為0.2mol,則c(NaOH)=$\frac{0.2mol}{0.04L}$=5mol/L,200mL時生成沉淀最多,溶液中的溶質為硫酸鈉,則c(H2SO4)=$\frac{5mol/L×0.2L×\frac{1}{2}}{0.5L}$=1mol/L,故B錯誤;
C、在加入240mLNaOH溶液時,Al(OH)3恰好全部轉化為NaAlO2,由B的計算可知氫氧化鈉溶液的濃度為5mol•L-1,故C正確;
D、與硫酸反應生成的氫氣的體積應為(0.15mol+0.3mol)×22.4 L•mol-1=10.08L,故D錯誤;故選C.
點評 本題考查混合物反應的計算,題目難度中等,明確圖象中曲線變化及其發生的化學反應為解答的關鍵,注意氫氧化鋁能溶解在NaOH溶液中,側重分析及計算能力的考查.


 金牌教輔培優優選卷期末沖刺100分系列答案
金牌教輔培優優選卷期末沖刺100分系列答案科目:高中化學 來源: 題型:選擇題
 它既不溶于水,也不溶于NaHCO3溶液.能夠跟1mol該化合物起反應的H2或HBr的最大用量分別是( )
它既不溶于水,也不溶于NaHCO3溶液.能夠跟1mol該化合物起反應的H2或HBr的最大用量分別是( )| A. | 1mol﹑2mol | B. | 4mol﹑4mol | C. | 4mol﹑2mol | D. | 4mol﹑1mol |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A | B | C | |
| ① | NaOH溶液 | Al(OH)3 | 稀硫酸 |
| ② | KOH溶液 | SiO2 | 稀鹽酸 |
| ③ | O2 | N2 | H2 |
| ④ | FeCl3溶液 | Cu | 濃硝酸 |
| A. | ①③ | B. | ①④ | C. | ②④ | D. | ②③ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 某同學為探究元素周期表中元素性質的遞變規律,設計了如下實驗.
某同學為探究元素周期表中元素性質的遞變規律,設計了如下實驗.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 9gD2O中含有的電子數為5NA | |
| B. | 4.5gSiO2晶體中含有的硅氧鍵的數目為0.15NA | |
| C. | 1molCH4分子中共價鍵總數為4NA | |
| D. | 7.1g C12與足量NaOH溶液反應轉移的電子數為0.2NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 混合溶液的pH值應等于7 | |
| B. | 如果酸是強酸,則pH一定小于7 | |
| C. | 如果堿是強堿,則pH一定不大于7 | |
| D. | 如果混合液的pH大于7,則堿一定為強堿 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 純堿溶液顯堿性的原因:CO32-+2H2O?H2CO3+2OH- | |
| B. | 氯化鐵溶液腐蝕銅線路板Cu+Fe3+=Cu2++Fe2+ | |
| C. | 稀硫酸與氫氧化鋇溶液恰好中和:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| D. | 氯氣溶于水:Cl2+H2O=H++Cl-+HClO |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 若溫度不變,容器體積擴大一倍,此時A的濃度是原來的0.48倍,則a+b大于d | |
| B. | 若從正反應開始平衡時A、B的轉化率相等,則A、B的物質的量之比為a:b | |
| C. | 若平衡體系中氣體M mol,再充入bmolB,達到平衡氣體量為(M+b)mol,則a+b=c+d | |
| D. | 若a+b=d,則當容器內溫度上升時,平衡向左移動,容器中氣體的壓強不變 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com